Оксиды ниобия
Рассматриваемый химический элемент может стать основой различных соединений. Самым распространенным можно назвать пятиокись ниобия. Среди особенностей данного соединения можно отметить нижеприведенные моменты:
- Оксид ниобия представлен белым кристаллическим порошком, который имеет кремовый оттенок.
- Вещество не растворяется в воде.
- Получаемое вещество сохраняет свою структуру при смешивании с большинства кислотами.

Ниобиевый штабик
К особенностям пентаоксида ниобия также можно отнести следующие свойства:
- Повышенная прочность.
- Высокая тугоплавкость. Вещество способно выдерживать температуру до 1490 градусов Цельсия.
- При нагреве поверхность окисляется.
- Реагирует на воздействие хлора, может восстанавливаться водородом.
Гидроксид ниобия в большинстве случаев применяется для получения высоколегированных марок стали, которые обладают довольно привлекательными эксплуатационными качествами.
использовать
Сверхпроводящий резонатор из ниобия высокой чистоты для лазера на свободных электронах в DESY .
Ниобий используется в качестве легирующей добавки для нержавеющих сталей, специальных нержавеющих сталей (например, труб для производства соляной кислоты) и цветных сплавов, поскольку легированные ниобием материалы характеризуются повышенной механической прочностью. Даже в концентрациях от 0,01 до 0,1 процента по массе ниобий в сочетании с термомеханической прокаткой может значительно повысить прочность и ударную вязкость стали. Первые попытки использовать ниобий в качестве легирующего элемента (замены вольфрама ) были предприняты в США в 1925 году. Обработанные таким образом стали часто используются при строительстве трубопроводов. В качестве сильного карбидообразователя ниобий также добавляют в сварочные материалы для связывания углерода.
Монета Австрия штамп 25 евро биметаллических с сердцевиной ниобия.
Другое использование:
- Применение в ядерной технологии из – за низкий сечение захвата для тепловых нейтронов .
- Производство сварочных электродов, стабилизированных ниобием, в качестве присадочных материалов для нержавеющих сталей , специальных нержавеющих сталей и сплавов на никелевой основе .
- Из-за своего голубоватого цвета он используется для пирсинга ювелирных изделий и изготовления ювелирных украшений.
- В алюминиевых сплавах он используется для производства легких, но жестких компонентов и транспортных средств, таких как обода велосипедов.
- В случае монет с ниобием (биметаллические монеты) цвет ядра ниобия может сильно различаться из-за физических процессов (например, для монет за 25 евро из Австрии).
Черная часть сопла ракеты изготовлена из ниобий-титанового сплава.
- Значительные количества феррониобов и ниобов никеля используются в металлургической промышленности для производства жаропрочных сплавов (никель, кобальт и сплавы на основе железа). Из него изготавливаются статические детали для стационарных и летающих газовых турбин, детали ракет и жаропрочные детали для печного строительства.
- Ниобий используется в качестве анодного материала в ниобиевых электролитических конденсаторах . Оксид ниобия, оксид ниобия (V), обладает высокой диэлектрической прочностью. Он наносится на поверхность ниобиевого анода в так называемом процессе формования и служит диэлектриком в этом конденсаторе. Ниобиевые электролитические конденсаторы конкурируют с более популярными танталовыми электролитическими конденсаторами .
- Стеклянные колбы галогенных ламп снаружи с буквой z. B. niobium, часть теплового излучения вольфрамовой нити отражается обратно внутрь. В результате может быть достигнута более высокая рабочая температура и, следовательно, большая световая отдача при меньшем потреблении энергии.
- В качестве катализатора (например, при производстве соляной кислоты, при синтезе биодизельного топлива и при производстве спиртов из бутадиена).
- Как ниобат калия (химическое соединение калия, ниобия и кислорода), который используется в качестве монокристалла в лазерной технологии и для нелинейных оптических систем.
- Использование в качестве электродного материала для
- Сверхпроводимость : При температурах ниже 9,5 К, чистый ниобий является типом II , сверхпроводник сплавы ниобия (с N, O, Sn, Alge, Ge) принадлежит к. Типу II веществ в дополнении к чистым элементам ниобию, ванадий и технеций -Superconductors является : Температура перехода этих сплавов составляет от 18,05 К ( ниобий-олово Nb 3 Sn) до 23,2 К ( ниобий-германий Nb 3 Ge). Сверхпроводящие объемные резонаторы из ниобия используются в ускорителях частиц (включая XFEL и в DESY в Гамбурге). – Для создания сильных магнитных полей до 20 Тесла используются сверхпроводящие магнитные катушки с проводами из ниобий-олова или ниобий-титана, например Б. в термоядерном реакторе ИТЭР 600 т ниобий-олово и 250 т ниобий-титан. Катушки сверхпроводящего магнита LHC также сделаны из сплавов ниобия.
- Благодаря своей биосовместимости ниобий используется для поверхностного покрытия имплантатов.
- Чтобы противодействовать межкристаллитной коррозии , ниобий используется в качестве легирующего элемента в хромистых сталях. Для этого он должен присутствовать как минимум в двенадцатикратной концентрации углерода. Ниобий образует карбиды быстрее, чем хром. Следовательно, не происходит образования богатых хромом карбидов, что означало бы, что обедненные хромом области развиваются в другом месте структуры.
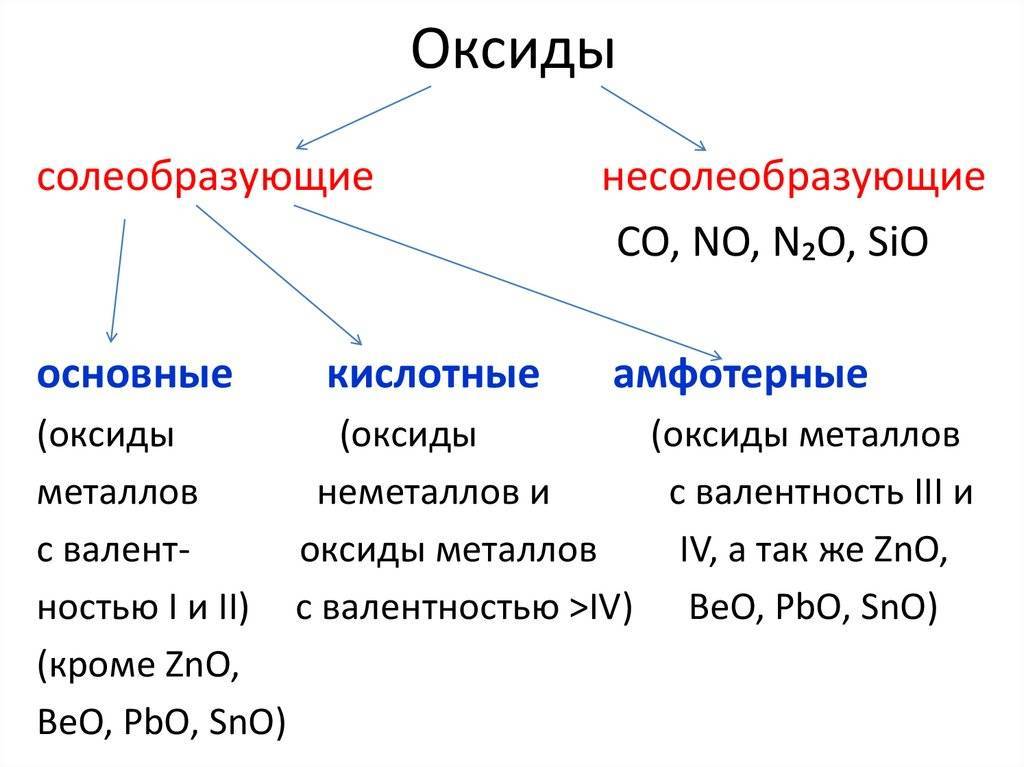
Номенклатура оксидов
Названия оксидов строятся по систематической номенклатуре следующим образом:
Пишем слово «оксид».
Указываем название второго химического элемента в родительном падеже.
Если этот элемент имеет переменную валентность, то указываем валентность элемента в этом соединении в скобках римской цифрой.
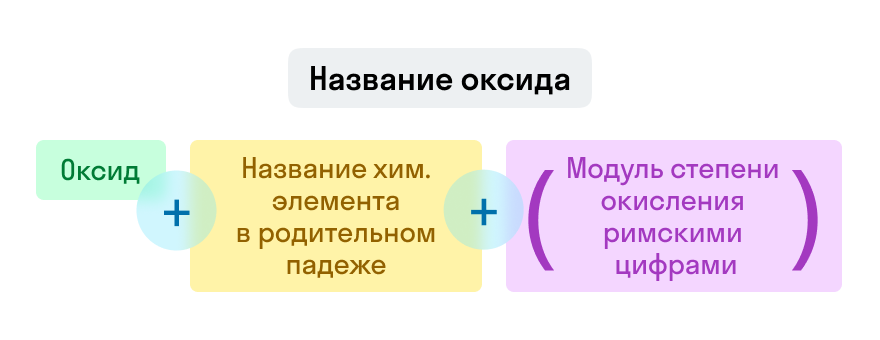
Примеры названий оксидов:
Fe2O3 — оксид железа (III). Читается: феррум два о три.
Na2O — оксид натрия. Читается: натрия два о.
SO3 — оксид серы (VI). Читается: эс о три.
До появления систематической номенклатуры вещества называли по присущим им специфическим свойства (цвету, запаху и т. д.). Такой способ названия веществ — тривиальная номенклатура. Некоторые названия используются и сейчас.
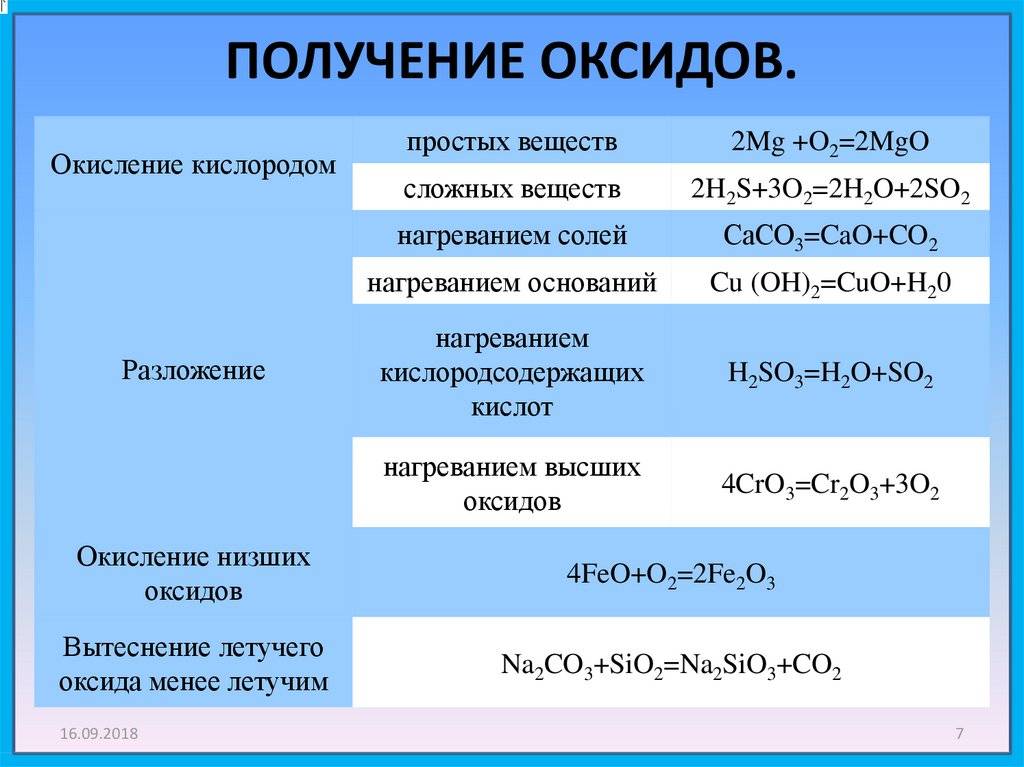
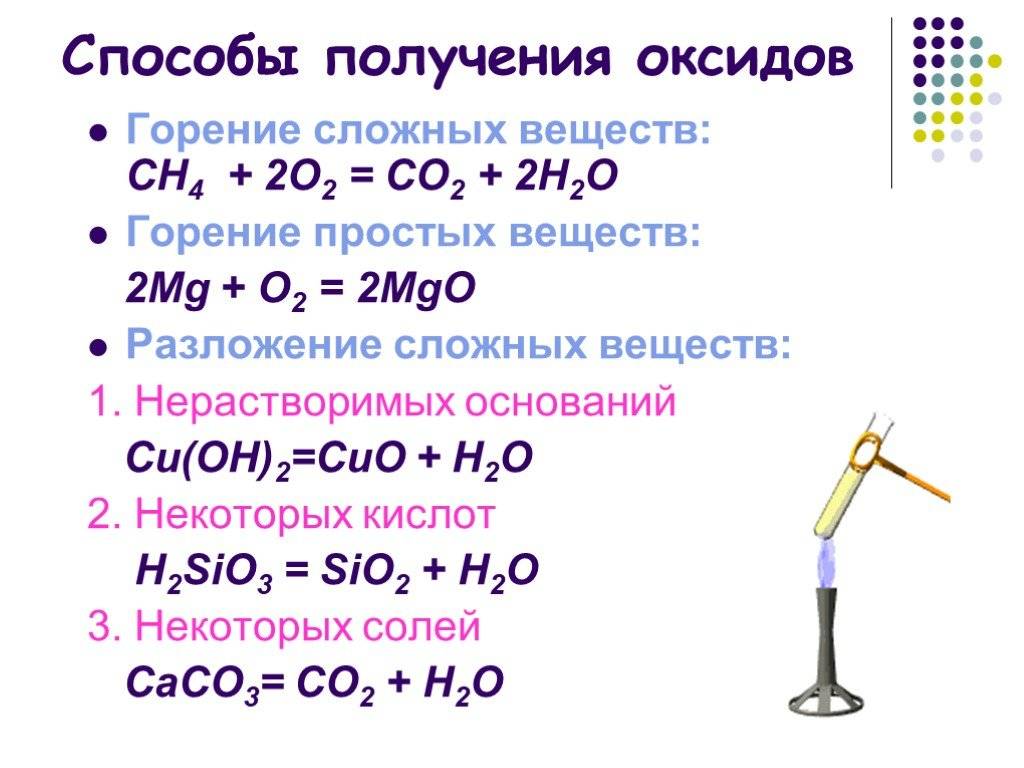
Взаимодействие с простыми веществами
с кислородом
Без нагревания бериллий и магний не реагируют ни с кислородом воздуха, ни с чистым кислородом ввиду того, что покрыты тонкими защитными пленками, состоящими соответственно из оксидов BeO и MgO. Их хранение не требует каких-либо особых способов защиты от воздуха и влаги, в отличие от щелочноземельных металлов, которые хранят под слоем инертной по отношению к ним жидкости, чаще всего керосина.
Be, Mg, Ca, Sr при горении в кислороде образуют оксиды состава MeO, а Ba – смесь оксида бария (BaO) и пероксида бария (BaO2):
2Mg + O2 = 2MgO
2Ca + O2 = 2CaO
2Ba + O2 = 2BaO
Ba + O2 = BaO2
Следует отметить, что при горении щелочноземельных металлов и магния на воздухе побочно протекает также реакция этих металлов с азотом воздуха, в результате которой, помимо соединений металлов с кислородом, образуются также нитриды c общей формулой Me3N2.
с галогенами
Бериллий реагирует с галогенами только при высоких температурах, а остальные металлы IIA группы — уже при комнатной температуре:
Мg + I2 = MgI2 – иодид магния
Са + Br2 = СаBr2 – бромид кальция
Ва + Cl2 = ВаCl2 – хлорид бария
с неметаллами IV–VI групп
Все металлы IIA группы реагируют при нагревании со всеми неметаллами IV–VI групп, но в зависимости от положения металла в группе, а также активности неметаллов требуется различная степень нагрева. Поскольку бериллий является среди всех металлов IIA группы наиболее химически инертным, при проведении его реакций с неметаллами требуется существенно большая температура.
Следует отметить, что при реакции металлов с углеродом могут образовываться карбиды разной природы. Различают карбиды, относящиеся к метанидам и условно считающимися производными метана, в котором все атомы водорода замещены на металл. Они так же, как и метан, содержат углерод в степени окисления -4, и при их гидролизе или взаимодействии с кислотами-неокислителями одним из продуктов является метан. Также существует другой тип карбидов – ацетилениды, которые содержат ион C22-, фактически являющийся фрагментом молекулы ацетилена. Карбиды типа ацетиленидов при гидролизе или взаимодействии с кислотами-неокислителями образуют ацетилен как один из продуктов реакции. То, какой тип карбида – метанид или ацетиленид — получится при взаимодействии того или иного металла с углеродом, зависит от размера катиона металла. С ионами металлов, обладающих малым значением радиуса, образуются, как правило, метаниды, с ионами более крупного размера – ацетилениды. В случае металлов второй группы метанид получается при взаимодействии бериллия с углеродом:
Остальные металлы II А группы образуют с углеродом ацетилениды:
С кремнием металлы IIA группы образуют силициды — соединения вида Me2Si, с азотом – нитриды (Me3N2), фосфором – фосфиды (Me3P2):
с водородом
Все щелочноземельные металлы реагируют при нагревании с водородом. Для того чтобы магний прореагировал с водородом, одного нагрева, как в случае со щелочноземельными металлами, недостаточно, требуется, помимо высокой температуры, также и повышенное давление водорода. Бериллий не реагирует с водородом ни при каких условиях.
Расчет числа валентности
Но если у вас нет периодической таблицы с валентностями, как вы можете их определить? Для этого необходимо помнить, что анион O2– вносит два отрицательных заряда в оксид металла. Следуя принципу нейтральности, эти отрицательные заряды должны нейтрализоваться положительными зарядами металла.
Следовательно, если количество атомов кислорода известно из химической формулы, валентность металла может быть определена алгебраически, так что сумма зарядов равна нулю.
Mn2ИЛИ7 у него семь атомов кислорода, поэтому его отрицательные заряды равны 7x (-2) = -14. Чтобы нейтрализовать отрицательный заряд -14, марганец должен давать +14 (14-14 = 0). Поднимая математическое уравнение, мы получаем:
2X – 14 = 0
Число 2 связано с наличием двух атомов марганца. Решение и решение для X, валентности металла:
Х = 14/2 = 7
Другими словами, каждый Mn имеет валентность +7.
Химические свойства
Химически ниобий довольно устойчив, но уступает в этом отношении танталу. На него практически не действуют соляная, ортофосфорная, разбавленная серная, азотная кислоты. Металл растворяется в плавиковой кислоте HF, смеси HF и HNO3, концентрированных растворах едких щелочей, а также в концентрированной серной кислоте при нагревании свыше 150 °C. При прокаливании на воздухе окисляется до Nb2О5. Для этого оксида описано около 10 кристаллических модификаций. При обычном давлении стабильна β-форма Nb2O5.
- При сплавлении Nb2O5 с различными оксидами получают ниобаты: Ti2Nb10O29, FeNb49O124. Ниобаты могут рассматриваться как соли гипотетических ниобиевых кислот. Они делятся на метаниобаты MNbO3, ортониобаты M3NbO4, пирониобаты M4Nb2O7 или полиниобаты M2O·nNb2O5 (M — однозарядный катион, n = 2-12). Известны ниобаты двух- и трехзарядных катионов.
- Ниобаты реагируют с HF, расплавами гидрофторидов щелочных металлов (KHF2) и аммония. Некоторые ниобаты с высоким отношением M2O/Nb2O5 гидролизуются:
- 6Na3NbO4 + 5H2O = Na8Nb6O19 + 10NaOH.
- Ниобий образует NbO2, NbO, ряд оксидов, промежуточных между NbO2,42 и NbO2,50 и близких по структуре к β-форме Nb2О5.
- С галогенами ниобий образует пентагалогениды NbHal5, тетрагалогениды NbHal4 и фазы NbHal2,67 — NbHal3+x, в которых имеются группировки Nb3 или Nb2. Пентагалогениды ниобия легко гидролизуются водой.
- В присутствии паров воды и кислорода NbCl5 и NbBr5 образуют оксигалогениды NbOCl3 и NbOBr3 — рыхлые ватообразные вещества.
- При взаимодействии ниобия и графита образуются карбиды Nb2C и NbC, твёрдые жаропрочные соединения. В системе Nb — N существуют несколько фаз переменного состава и нитриды Nb2N и NbN. Сходным образом ведёт себя ниобий в системах с фосфором и мышьяком. При взаимодействии ниобия с серой получены сульфиды: NbS, NbS2 и NbS3. Синтезированы двойные фториды Nb и калия (натрия) — K2[NbF7].
- Из водных растворов выделить электрохимически ниобий пока не удалось. Возможно электрохимическое получение сплавов, содержащих ниобий. Электролизом безводных солевых расплавов может быть выделен металлический ниобий.
Тугоплавкий металл ниобий
Калькулятор металлопроката С высоким эл. сопротивлением
| Ниобий сочетает в себе множество полезных физических, механических и технологических свойств, которые определяют его применение от металлургии до ядерной физики. На странице представлено описание данного металла: физические, химические свойства, области применения, марки, виды продукции. |
Ниобий (Nb) — химический элемент V группы периодической системы, атомный номер 41, атомная масса 92,90. Блестящий серебристо-серый металл, относящийся к классу тугоплавких. Имеет плотность 8,57 г/см3, температуру плавления tпл. = 2468 °С, температуру кипения tкип. = 4742 °С. Обладает хорошей прочностью, твердостью и пластичностью.
Описываемый химический элемент относится к редким тугоплавким металлам. В рудах всегда присутствует совместно с танталом. Основные минералы — колумбит-танталит, лопарит, пирохлор.
Открытие ниобия было сделано английским ученым Чарльзом Хэтчетом в 1801 г. Тогда этот металл получил название “колумбий”. До 1844 г. считалось, что Ta и Nb являются одним и тем же элементом. Получить Nb в чистом виде удалось лишь в конце XIX века. Это было сделано французским химиком Анри Муассаном путем восстановления оксида ниобия углеродом в электропечи.
| Атомный номер | 41 |
| Атомная масса, а.е.м | 92,90 |
| Радиус атома, пм | 146 |
| Плотность, г/см³ | 8,57 |
| Молярная теплоемкость, Дж/(K·моль) | 22,44 |
| Теплопроводность, Вт/(м·K) | 53,7 |
| Температура плавления, °С | 2468 |
| Температура кипения, °С | 4742 |
| Теплота плавления, кДж/моль | 26,8 |
| Теплота испарения, кДж/моль | 680 |
| Молярный объем, см³/моль | 10,8 |
| Группа металлов | Тугоплавкий металл |
| Ковалентный радиус, пм | 164 |
| Радиус иона, пм | (+5e) 69 |
| Электроотрицательность (по Полингу) | 1,6 |
| Электродный потенциал | |
| Степени окисления | 5, 4, 3, 2, 1 |
Промышленное применение находит ка чистый ниобий, не содержащий никаких легирующих элементов, так и сплавы на его основе.
- Нб1 — ниобий высокой чистоты с количеством Nb — 99,84%; поставляется в виде слитков.
- НбШ00, НбШ0, НбШ1 — чистый ниобий в виде штабиков, содержание Nb составляет 99,77%, 99,56%, 99,37% соответственно.
- НбП, НбП-а, НбП-б — чистый ниобий в виде порошка.
- ВН1, ВН2, ВН2АЭ — сплавы ниобия с молибденом; молибденом и цирконием. Первая марка содержит в своем составе 3,8-52% Mo, вторая — 3,5-4,7% Mo и 0,5-0,9% Zr.
- НбЦ, НбЦУ, Нб5В2МЦ, Нб10В2МЦ, Нб10В5МЦУ — группа сплавов на основе ниобия, в состав которых в разных количествах входят вольфрам, молибден, цирконий, углерод.
- Достоинства:
- имеет высокую температуру плавления;
- стоек к коррозии во многих химически агрессивных средах;
- имеет хорошие технологические и механические свойства — хорошая пластичность и свариваемость, прочность.
- Недостатки:
- относительно небольшой процент содержания в земной коре;
- достаточно высокая стоимость (дешевле, чем тантал, но существенно дороже вольфрама и молибдена).
Основные направления использования металла следующие:
- химическая и атомная промышленность;
- металлургия;
- электроника;
- ядерная физика;
- авиастроение.
Высокая прочность и хорошая стойкость к коррозии в том числе и при высоких температурах позволяют применять ниобий в качестве конструкционного материала. Подобное использование характерно для изготовления деталей летательных аппаратов, труб и контейнеров для передачи и хранения жидких металлов, оболочек для радиоактивных тепловыделяющих элементов. Nb — распространенный легирующий элемент, который позволяет существенно улучшать свойства содержащих его сталей и сплавов. Nb передает в легируемые материалы прочность, коррозионную стойкость, тугоплавкость. Рассматриваемый металл также применяется в изготовлении конденсаторов — важных элементов электронной промышленности. По своим характеристикам ниобиевые конденсаторы уступают танталовым, однако имеют существенно меньшую цену.
Соединения ниобия Nb3Sn, Nb3Ge, NbN и NbTi применяются для производства сверхпроводников. Такие свойства востребованы в научном оборудовании, используемом, например, в физических экспериментах.
Современное промышленное производство предлагает практически полный спектр стандартных заготовок, активно используемых в различных областях. Из круглого проката можно выделить ниобиевую проволоку, пруток и трубу. Плоский прокат представляет ниобиевая фольга и лента, листы, полосы. К исходному сырью можно отнести порошок ниобия, который занимает основополагающее место в цепочке производства изделий из данного металла.
Примечания[ | ]
- Michael E. Wieser, Norman Holden, Tyler B. Coplen, John K. Böhlke, Michael Berglund, Willi A. Brand, Paul De Bièvre, Manfred Gröning, Robert D. Loss, Juris Meija, Takafumi Hirata, Thomas Prohaska, Ronny Schoenberg, Glenda O’Connor, Thomas Walczyk, Shige Yoneda, Xiang‑Kun Zhu. Atomic weights of the elements 2011 (IUPAC Technical Report) (англ.) // Pure and Applied Chemistry. — 2013. — Vol. 85, no. 5. — P. 1047—1078. — doi:10.1351/PAC-REP-13-03-02.
- Редкол.:Кнунянц И. Л. (гл. ред.). Химическая энциклопедия: в 5 т. — Москва: Советская энциклопедия, 1992. — Т. 3. — С. 249. — 639 с. — 50 000 экз. — ISBN 5—85270—039—8.
- Materials Handbook: A Concise Desktop Reference, François Cardarelli, 2000, с.157.
- Венецкий С.И. Сорок первый // Рассказы о металлах. — Москва: Металлургия, 1979. — 240 с. — 60 000 экз.
- J.P. Riley and Skirrow G. Chemical Oceanography V. I, 1965
- Редкий ниобий на редкоземельном рынке
- Месторождение ниобия и тантала
- Larry D. Cunningham. USGS Minerals Information: Niobium (Columbium) and Tantalum(неопр.) . Minerals.usgs.gov (5 апреля 2012). Дата обращения: 17 августа 2012. Архивировано 25 ноября 2012 года.
- Запуск коллайдера//«Наука и технологии России» (неопр.) (недоступная ссылка). Дата обращения: 7 февраля 2009. Архивировано 21 сентября 2008 года.
- Ниобиевые монеты: очарование цвета (неопр.) (недоступная ссылка). Euro-Coins.News. Дата обращения: 12 марта 2012. Архивировано 28 мая 2012 года.
- Каталог коллекционных монет Австрии из драгоценных металлов (неопр.) (недоступная ссылка). Мир монет. Дата обращения: 19 марта 2012. Архивировано 15 февраля 2012 года.
- Для этого используется также титан в тех же количествах.
- Coin of time (неопр.) (недоступная ссылка). Дата обращения: 5 декабря 2007. Архивировано 12 марта 2008 года.
- Coin of time2 (неопр.) (недоступная ссылка). Дата обращения: 5 декабря 2007. Архивировано 22 мая 2009 года.
Производство
Производители ниобия в 2006-2015 гг.
После отделения от других минералов получают смешанные оксиды тантала Ta 2 O 5 и ниобия Nb 2 O 5 . Первым этапом обработки является реакция оксидов с плавиковой кислотой :
- Ta 2 O 5 + 14 HF → 2 H 2 [TaF 7 ] + 5 H 2 O
- Nb 2 O 5 + 10 HF → 2 H 2 [NbOF 5 ] + 3 H 2 O
Первое разделение в промышленном масштабе, разработанное де Мариньяком , использует различные растворимости комплексных фторидов ниобия и тантала , моногидрата оксипентафторониобата калия (K 2 [NbOF 5 ] · H 2 O) и гептафтортанталата калия (K 2 [TaF 7 ]) в воды. В более новых процессах используется жидкостная экстракция фторидов из водного раствора органическими растворителями, такими как циклогексанон . Комплексные фториды ниобия и тантала экстрагируют отдельно из органического растворителя водой и либо осаждают добавлением фторида калия с получением комплекса фторида калия, либо осаждают аммиаком в качестве пентоксида:
- H 2 [NbOF 5 ] + 2 KF → K 2 [NbOF 5 ] ↓ + 2 HF
С последующим:
- 2 H 2 [NbOF 5 ] + 10 NH 4 OH → Nb 2 O 5 ↓ + 10 NH 4 F + 7 H 2 O
Для восстановления до металлического ниобия используется несколько методов . Электролизе расплавленной смеси K 2 [NbOF 5 ] и хлорида натрия является одним; другой – восстановление фторида натрием . С помощью этого метода можно получить ниобий относительно высокой чистоты. При крупномасштабном производстве Nb 2 O 5 восстанавливают водородом или углеродом. В алюмотермической реакции смесь оксида железа и оксида ниобия реагирует с алюминием :
- 3 Nb 2 O 5 + Fe 2 O 3 + 12 Al → 6 Nb + 2 Fe + 6 Al 2 O 3
Для усиления реакции добавляют небольшие количества окислителей, таких как нитрат натрия . В результате получается оксид алюминия и феррониобий , сплав железа и ниобия, используемый в производстве стали. Феррониобий содержит от 60 до 70% ниобия. Без оксида железа для производства ниобия используется алюминотермический процесс. Для получения класса сверхпроводящих сплавов необходима дополнительная очистка . Электронно-лучевая плавка в вакууме – метод, используемый двумя основными распространителями ниобия.
По состоянию на 2013 год CBMM из Бразилии контролировал 85 процентов мирового производства ниобия. По оценкам Геологической службы США, производство увеличилось с 38 700 тонн в 2005 году до 44 500 тонн в 2006 году. Мировые ресурсы оцениваются в 4,4 миллиона тонн. За десятилетний период с 1995 по 2005 год производство увеличилось более чем вдвое, начиная с 17 800 тонн в 1995 году. В период с 2009 по 2011 год производство было стабильным на уровне 63 000 тонн в год с небольшим снижением в 2012 году до 50 000 тонн в год. .
| Страна | 2000 г. | 2001 г. | 2002 г. | 2003 г. | 2004 г. | 2005 г. | 2006 г. | 2007 г. | 2008 г. | 2009 г. | 2010 г. | 2011 г. | 2012 г. | 2013 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Австралия | 160 | 230 | 290 | 230 | 200 | 200 | 200 | ? | ? | ? | ? | ? | ? | ? |
| Бразилия | 30 000 | 22 000 | 26 000 | 29 000 | 29 900 | 35 000 | 40 000 | 57 300 | 58 000 | 58 000 | 58 000 | 58 000 | 45 000 | 53 100 |
| Канада | 2290 | 3 200 | 3 410 | 3 280 | 3 400 | 3 310 | 4 167 | 3020 | 4380 | 4330 | 4 420 | 4 630 | 4,710 | 5 260 |
| Конго ДР | ? | 50 | 50 | 13 | 52 | 25 | ? | ? | ? | ? | ? | ? | ? | ? |
| Мозамбик | ? | ? | 5 | 34 | 130 | 34 | 29 | ? | ? | ? | ? | ? | ? | ? |
| Нигерия | 35 год | 30 | 30 | 190 | 170 | 40 | 35 год | ? | ? | ? | ? | ? | ? | ? |
| Руанда | 28 год | 120 | 76 | 22 | 63 | 63 | 80 | ? | ? | ? | ? | ? | ? | ? |
| Мир | 32 600 | 25 600 | 29 900 | 32 800 | 34 000 | 38 700 | 44 500 | 60 400 | 62 900 | 62 900 | 62 900 | 63 000 | 50 100 | 59 400 |
Меньшие количества находятся на месторождении Каньяка в Малави ( рудник Каньяка ).
Получение ванадия, ниобия, тантала
Примерно половину всего производимого ванадия получают переработкой железных ванадийсодержащих руд. На первом этапе производства, в домне ванадий из руды переходит в чугун, а при выплавке стали – в шлаки в форме оксида ванадия (III) и железа (II). Такие шлаки и являются основным сырьем при производстве ванадия.
Шлак смешивают с хлоридом натрия, после чего прокаливают при температуре 800°C на воздухе:
4FeV2O4+8NaCl+7O2 → 8NaVO3+2Fe2O3+4Cl2↑
Выделяющийся в ходе реакции хлор реагирует со шлаком:
2FeV2O4+9Cl2 = 4VOCl3+2FeCl3+2O2↑
Образующийся в ходе реакции плав, затем выщелачивается содой, и на последнем этапе – раствором серной кислоты осаждается оксид ванадия (V).
Металлический ванадий получают восстановлением из оксида кальцием:
V2O5+5Ca = 2V+5CaO
Поскольку ниобий и тантал в рудах содержатся в очень малых количествах (сотые доли процента), перед их промышленным использованием, такие руды предварительно обогащают при помощи различных методов (магнитных, химических, флотационных, гравитационных). Полученные, в ходе обогащения руд, концентраты (ниобаты и танталаты металлов) разлагают в горячей плавиковой кислоте, а затем спекают с содой или хлорируют. Самым сложным этапом является разделение соединений ниобия и тантала, посколкьу эти металлы обладают очень схожими свойствами.
Физические свойства ниобия
Металл серого цвета с белым оттенком. Относится к группе тугоплавких сплавов. Температура плавления составляет 2500 ºС. Точка кипения 4927 ºС. Отличается повышенным значением жаростойкости. Не теряет своих свойств при температурах работы свыше 900 ºС.
Механические характеристики также находятся на высоком уровне. Плотность составляет 8570 кг/м3 при аналогичном показателе стали 7850 кг/м3. Устойчив к работе как при динамических нагрузках, так и циклических. Предел прочности на разрыв – 34,2 кг/мм2. Обладает высокой пластичностью. Коэффициент относительного удлинения варьируется пределах 19-21%, что позволяет получать из него листовой прокат ниобия толщиной до 0,1 мм.
Твердость связана с чистотой металла от вредных примесей и повышается с увеличением их в составе. Чистый ниобий имеет 450 единиц шкалы твердости по Бринеллю.
Ниобий хорошо поддается обработке давлением при температурах ниже -30 ºС и плохо резанием.
Теплопроводность существенно не изменяется при больших колебаниях температуры. Например, при 20 ºС она составляет 51,4 вт/ (м К), а при 620 С повышается всего на 4 единицы. Ниобий конкурирует в электропроводности с такими элементами как медь и алюминий. Электросопротивление — 153,2 нОм м. Относится к категории сверхпроводящих материалов. Температура, при которой сплав переходит в режим сверхпроводника, составляет 9,171 К.
Крайне устойчив к воздействию кислой среды. Такие распространённые кислоты как серная, соляная, ортофосфорная, азотная никак не влияют на его химическую структуру.
При температурах свыше 250 ºС ниобий начинает активно окисляться кислородом, а также вступать в химические реакции с молекулами водорода и азота. Данные процессы увеличивают хрупкость металла, тем самым снижая его прочность.
- Не относится к аллергенным материалам. Внедренный в тело человека, он не вызывает реакции отторжения организмом.
- Является металлом первой группы свариваемости. Сварные швы получаются плотными и не требуют подготовительных операций. Устойчивые к образованию трещин.
Меры предосторожности
| Опасности | |
|---|---|
| NFPA 704 (огненный алмаз) |
Ниобий не имеет известной биологической роли. В то время как ниобиевая пыль является раздражителем глаз и кожи и потенциально опасна возгорания, элементарный ниобий в более широком масштабе физиологически инертен (и, следовательно, гипоаллергенен) и безвреден. Он часто используется в ювелирных изделиях и был протестирован для использования в некоторых медицинских имплантатах.
Большинство людей редко сталкивается с ниобийсодержащими соединениями, но некоторые из них токсичны. Кратковременное и долгосрочное воздействие ниобатов и хлорида ниобия, двух химикатов, растворимых в воде, было протестировано на крысах. Крысы, получавшие однократную инъекцию пентахлорида ниобия или ниобатов, показывают среднюю летальную дозу (LD 50 ) от 10 до 100 мг / кг. При пероральном приеме токсичность ниже; исследование на крысах показало, что LD 50 через семь дней составляет 940 мг / кг.
Применение ниобия
Применение ниобия становится все более распространенным, что объясняется большим количеством его преимуществ и важных характеристик. Основными отраслями, где используется ниобий, являются строительство различных видов транспортной техники, от космических ракет до компонентов других летательных аппаратов. Обширно его использование в электронике и радиотехнике.
При этом в различных отраслях используется в своих различных формах. К примеру, чистый ниобий используется для создания деталей летательных аппаратов, контейнеров и труб для жидких металлов.
Сплавы ниобия позволяют легировать цветные металлы, в том числе и уран. В результате они перестают подвергаться воздействию щелочных соединений.
Вычислительные устройства также подразумевают использования ниобия, поскольку он требуется для производства криотронов – сверхпроводящих элементов. К тому же, строительство большого адронного коллайдера было бы невозможно без использования соединений данного металла.
Высокая удельная емкость металла обусловила его применение при изготовлении электролитических конденсаторов. Стоит отметить, что использование тантала позволяет производить конденсаторы более высокого качества, однако в вопросах надежности конденсаторы из ниобия существенно лучше.
Наконец, ниобий используется при изготовлении памятных монет в некоторых странах мира. Конкретная формула сплава и определяет ценность этих монет.