Изотопы и их применение
Основная статья: Изотопы кремния
Кремний состоит из стабильных изотопов 28Si (92,23 %), 29Si (4,67 %) и 30Si (3,10 %). Остальные изотопы являются радиоактивными.
Ядро 29Si (как и протон) имеет ядерный спин I = 1/2 и все шире используется в спектроскопии ЯМР. 31Si, образующийся при действии нейтронов на 30Si, имеет период полураспада равный 2,62 ч. Его можно определить по характеристическому β-излучению, и он очень удобен для количественного определения кремния методом нейтронно-активационного анализа. Радиоактивный нуклид 32Si имеет самый большой период полураспада (~170 лет) и является мягким (низкоэнергетическим) β-излучателем.
Сфера применения
Древесный уголь используется в промышленности в следующих целях:
- для применения в составе фильтров;
- для плавки кристаллического кремния;
- для использования в металлургии (насыщение стали углеродом, получение чистых сплавов);
- для производства стекла, некоторых видов пластмасс, красок;
- для изготовления натурального красителя для пищевой промышленности;
- для изготовления активированного угля;
- для использования в сельском хозяйстве;
- для применения в качестве удобного бытового топлива для печей, каминов, мангалов.
При сжигании в печах и каминах данный вид топлива сгорает практически без языков пламени, обеспечивая ровный и интенсивный жар. Наиболее высоко ценится продукт марки А, который изготавливается из твердых пород древесины.
Современность
В конце XX был изготовлен первый кристалл карборунда, до этого он был известен только в виде порошка. Как только появилась возможность синтезировать кристалл — его синтезировали. Результат оказался поразительным. По многим показателям карборунд превосходил алмаз.
- степень светопреломления на четверть выше;
- дисперсия — в два с половиной.

То есть он лучше блестит и даёт больше радужных бликов. Казалось бы — вот она, удача. Его действительно признали лучшей имитацией алмаза. Но в массовым он так и не стал. Делать ювелирные изделия с карборудном с точки зрения коммерции бессмысленно.
Производство украшений из камня слишком сложное и затратное дело. Крупный образец будет стоить порядка 500 долларов за карат. Сомнительно, что найдутся любители покупать искусственные камни за такие деньги. Даже если они высокотехнологичные и сверхблестящие. Сейчас кристаллы карбида кремния делает только одна американская компания, а в продаже он встречается реже, чем бриллиант.
Теоретически камень должен быть красивым: блестящий, сияющий, с радужной игрой света на гранях.
Но ценители камня его не очень ценят. На то есть несколько причин:
- яркие переливы света непривычны глазу и скорее раздражают, создают впечатление безвкусности и кичливости;
- прозрачных и чистых по цвету камней нет. Все они имеют пыльный зеленоватый оттенок. Химики пока с этим ничего поделать не могут;
- лучики света, которые отбрасывает бриллиант плотные, яркие, с насыщенными оттенка. Карборунд даёт более прозрачные и тёмные отблески.
Как видим, искусственному муассаниту не удалось превзойти алмаз и вытеснить его с ювелирных прилавков.

Непрозрачные недорогие образцы предприимчивые итальянцы продают как куски лавы Везувия.
Однако у карборунда есть ряд преимуществ:
- он не оставляет на себе жировых отпечатков. Если долго щупать бриллиант, он покроется жировой плёнкой и блестеть перестанет. Карборунд к этому невосприимчив. сколько его не трогай — он продолжит блестеть;
- поскольку карборунд выращен искусственно, он лишён дефектов. Его ограняют в идеальные, математически точно выверенные кристаллы. К тому же на материале можно не экономить. С бриллиантами это не всегда проходит. Иногда хочет сохранить вес камня и умышленно нарушает пропорции, иногда обходит дефекты. Браком это не считаются. Такие бриллианты хоть и стоят ниже, но на рынок поступают;
- в экстремальных температурах (около 1000 градусов Цельсия) алмаз горит, а карборунд нет. Вы можете кинуть платиновое кольцо в угольную печь и оно не пострадает.
Кроме этого он прочный, лишь незначительно уступает алмазу. К тому же он инертный — не вступает в реакцию с другими веществами (кроме плавиковой, азотной и ортофосфорной кислот), отличается высокой теплопроводностью, плотностью электрического тока и электрическим напряжением, имеет малый коэффициент теплового расширения и не имеет фазовых переходов, разрушающих кристалл.

Сейчас карборунд производят методом термического разложения полиметилсилана при низких температурах в присутствии инертного газа. Полученный материал применяется во многих сферах жизни.
Применяется в качестве:
- абразив для шлифования и напыление для пил;
- сырьё для режущих инструментов;
- полупроводник в электротехнической промышленности;
- катализатор в химической промышленности;
- подшипники и элементы оборудования в плавильных печах, поскольку он выдерживает нагрузку до 1700 градусов Цельсия;
- сырьё для производства бронежилетов;
- основа для сверхмощных светодиодов;
- сырьё для изготовления высококачественных дисковых тормозов;
- сырьё для создания зеркальных деталей в оптических системах.
Это далеко не всё. Камень используется в ядерной энергетике, строительстве, органическом синтезе.
Магические и лечебные свойства
О необычайных возможностях камня сложно говорить — это ненатуральный материал. Всё, что выращено в лаборатории не обладает магическими свойствами. Такие соединения синтезируются за несколько часов. Они порождение не Земли, а человеческого ума.
В карборунде этого нет. Он пустой. Если же удастся раздобыть украшение с ним, стоит помнить, что любая пустота рано или поздно чем-то наполняется. Так и с камнем. Владелец передаёт ему энергетику, предопределяя действие камня.
Если долго носить кольцо с искусственным минералом и постоянно копить в себе негатив, выплёскивать его наружу, то когда-то камень перенасытится этой информацией и начнёт её передавать хозяину и всем окружающим. Это станет негативный и злой талисман, который начнёт нести горе.
Чтобы этого избежать, в присутствии камня надо думать о хорошем, загадывать добрые желания и хвалить себя. Талисман можно смело передавать по наследству — он будет защищать всю семью. Но на создание семейной реликвии уйдут десятилетия.
Карборунд — распространённый в промышленности и редкий в ювелирном деле материал. Если же удастся найти с ним украшение — оно будет служить долго и впечатлять блеском.
Что такое кремний
Для начала давайте остановимся на общей характеристике кремния. От 27,6 до 29,5% массы земной коры составляет кремний. В морской воде концентрация элемента тоже изрядная – до 3 мг/л.
По распространенности в литосфере кремний занимает второе почетное место после кислорода. Однако наиболее известная его форма – кремнезем, является диоксидом, и именно его свойства и стали основой для столь широкого применения.
О том, что такое кремний, расскажет этот видеосюжет:
Понятие и особенности
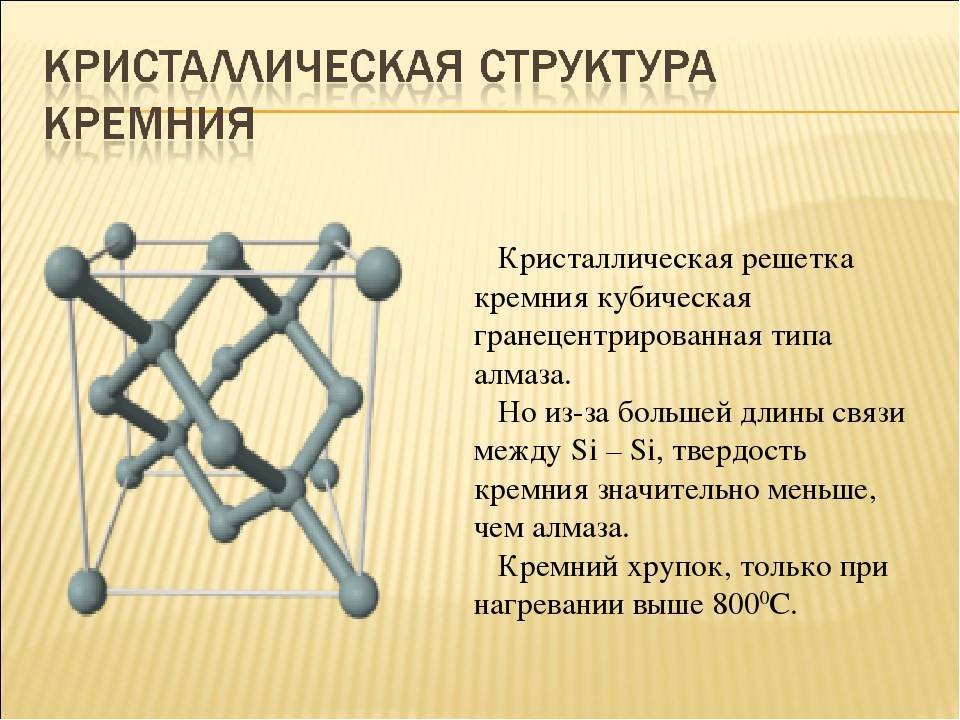
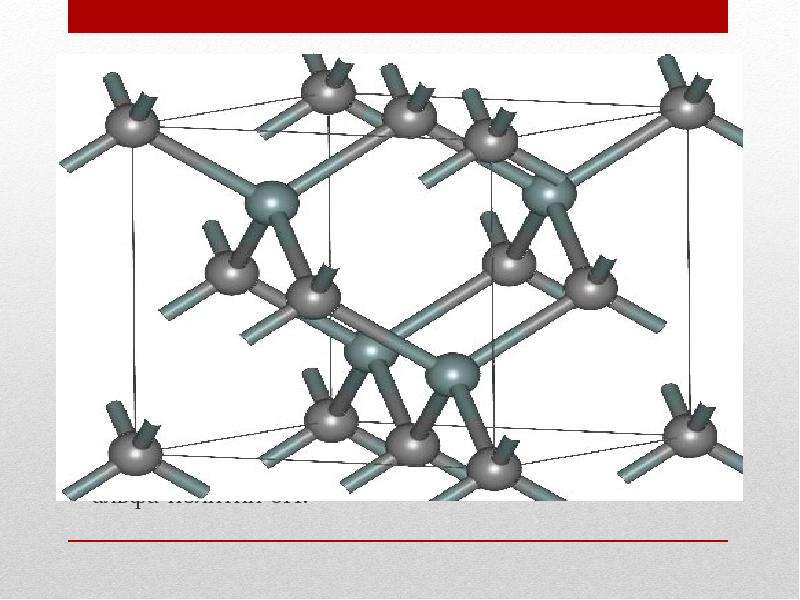
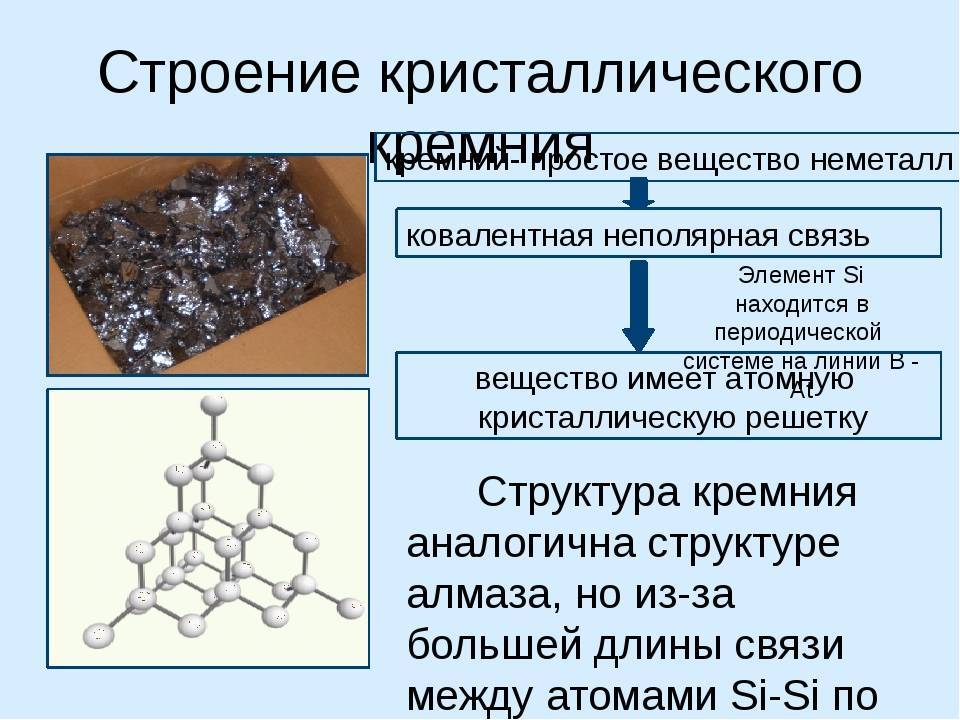
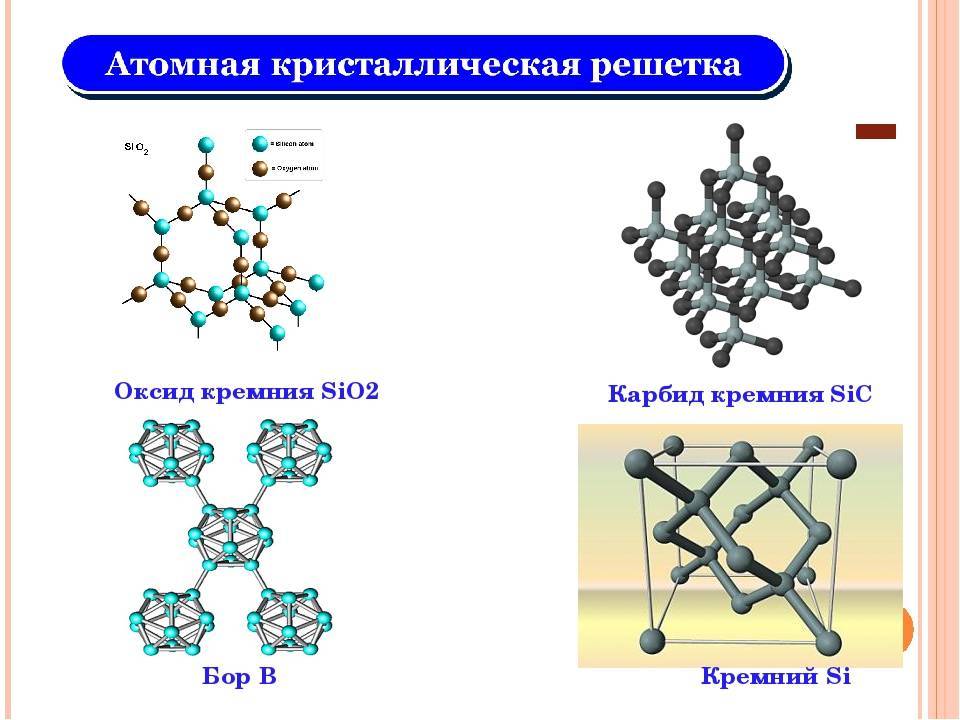
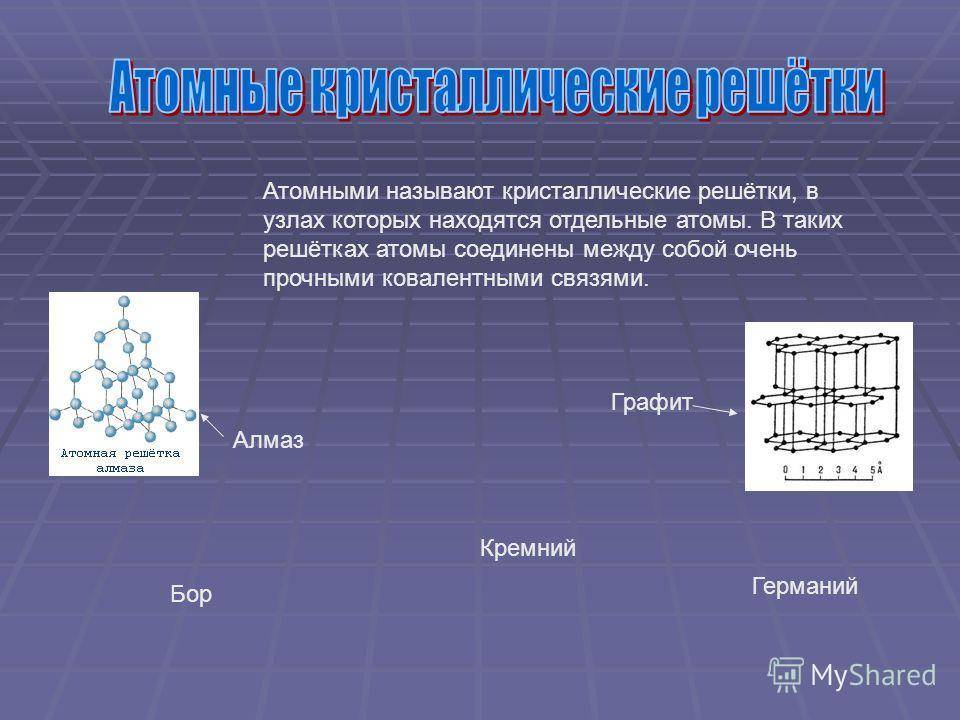
Кремний – неметалл, однако при разных условиях может проявлять и кислотные, и основные свойства. Является типичным полупроводником и чрезвычайно широко используется в электротехнике. Физические и химические его свойства во многом определяются аллотропным состоянием. Чаще всего дело имеют с кристаллической формой, поскольку ее качества более востребованы в народном хозяйстве.
- Кремний – один из базовых макроэлементов в человеческом теле. Его нехватка губительно сказывается на состоянии костной ткани, волос, кожи, ногтей. Кроме того, кремний оказывает влияние на работоспособность иммунной системы.
- В медицине элемент, вернее говоря, его соединения нашли свое первое применение именно в этом качестве. Вода из колодцев, выложенных кремнием, отличались не только чистотой, но и положительно сказывалась на стойкости к инфекционным болезням. Сегодня соединение с кремнием служат основой для препаратов против туберкулеза, атеросклероза, артрита.
- В целом неметалл малоактивен, однако и в чистом виде встретить его сложно. Связано это с тем, что на воздухе он быстро пассивируется слоем диоксида и перестает реагировать. При нагревании химическая активность увеличивается. В результате человечество гораздо ближе знакомо с соединениями вещества, а не с ним самим.
Так, кремний образует сплавы практически со всеми металлами – силициды. Все они отличаются тугоплавкостью и твердостью и применяются на соответствующих участках: газовые турбины, нагреватели печей.
Размещается неметалл в таблице Д. И. Менделеева в 6 группе вместе с углеродом, германием, оловом, что указывает на определенную общность с этими веществами. Так, с углеродом его «роднит» способность к образованию соединений по типу органических. При этом кремний, как и германий может проявить свойства металла в некоторых химических реакциях, что используется в синтезе.
Плюсы и минусы
Как и всякое другое вещество с точки зрения применения в народном хозяйстве, кремний обладает определенными полезными или не слишком качествами. Важны они именно для определения области использования.
- Немалым достоинством вещества является его доступность. В природе он, правда, находится не в свободном виде, но все же, технология получения кремния не так уж и сложна, хотя и энергозатратна.
- Второе важнейшее достоинство – образование множества соединений с необыкновенно полезными свойствами. Это и силаны, и силициды, и диоксид, и, конечно, разнообразнейшие силикаты. Способность кремния и его соединений образовывать сложные твердые растворы практически бесконечна, что позволяет бесконечно же получать самые разные вариации стекла, камня и керамики.
- Полупроводниковые свойства неметалла обеспечивает ему место базового материала в электро- и радиотехнике.
- Неметалл является нетоксичным, что допускает применение в любой отрасли промышленности, и при этом не превращает технологический процесс в потенциально опасный.
К недостаткам материала можно отнести лишь относительную хрупкость при хорошей твердости
Кремний не используется для несущих конструкций, но зато это сочетание позволяет обрабатывать должным образом поверхность кристаллов, что важно для приборостроения
Давайте теперь поговорим про основные свойства кремния.
Получение
Свободный кремний получается при прокаливании мелкого белого песка (диоксида кремния) с магнием:
- SiO2+2Mg → 2MgO+Si{\displaystyle {\mathsf {SiO_{2}+2Mg\ \rightarrow \ 2MgO+Si}}}
При этом образуется аморфный кремний, имеющий вид бурого порошка.
В промышленности кремний технической чистоты получают, восстанавливая расплав SiO2коксом при температуре около 1800 °C в рудотермических печах шахтного типа. Чистота полученного таким образом кремния может достигать 99,9 % (основные примеси — углерод, металлы).
Возможна дальнейшая очистка кремния от примесей.
- Очистка в лабораторных условиях может быть проведена путём предварительного получения силицида магния Mg2Si. Далее из силицида магния с помощью соляной или уксусной кислот получают газообразный моносилан SiH4. Моносилан очищают ректификацией, сорбционными и др. методами, а затем разлагают на кремний и водород при температуре около 1000 °C.
- Очистка кремния в промышленных масштабах осуществляется путём непосредственного хлорирования кремния. При этом образуются соединения состава SiCl4, SiHCl3 и SiH2Cl2. Их различными способами очищают от примесей (как правило, перегонкой и диспропорционированием) и на заключительном этапе восстанавливают чистым водородом при температурах от 900 до 1100 °C.
- Разрабатываются более дешёвые, чистые и эффективные промышленные технологии очистки кремния. На 2010 г. к таковым можно отнести технологии очистки кремния с использованием фтора (вместо хлора); технологии, предусматривающие дистилляцию монооксида кремния; технологии, основанные на вытравливании примесей, концентрирующихся на межкристаллитных границах.
Содержание примесей в доочищенном кремнии может быть снижено до 10−8—10−6 % по массе. Более подробно вопросы получения сверхчистого кремния рассмотрены в статье Поликристаллический кремний.
Способ получения кремния в чистом виде разработан Николаем Николаевичем Бекетовым.
В России технический кремний производится «ОК Русал» на заводах в г. Каменск-Уральский (Свердловская область) и г. Шелехов (Иркутская область); доочищенный по хлоридной технологии кремний производит группа «Nitol Solar» на заводе в г. Усолье-Сибирское.
Применение материала
Основной областью применения карбида кремния является электроника и энергетика. Это вещество используется при производстве полупроводниковых механизмов, светодиодов, резисторов, транзисторов и счетчиков энергии. Эти приспособления обладают высокой прочностью и могут стабильно функционировать в течение 10 лет. Они применяются в высокочастотной электронике. Изделия из карбида кремния отличаются следующими свойствами:
- Обладают большой шириной запрещенной зоны;
- Могут функционировать при высоких температурах (до 600 °C);
- Располагают повышенной теплопроводностью, в отличие от приборов, выполненных из арсенида галлия и иных минералов.
- Устойчивы к радиации и воздействию электрических зарядов.
Благодаря высокой огнеупорности и теплостойкости материала, он активно применяется в металлургии и химической промышленности. Из твердого раствора карборунда изготавливается множество нагревательных приборов, способны работать при высоких температурах (до 2000 °C). Эти приспособления могут функционировать в нейтральных или восстановленных средах. Нагревательные элементы активно используются при термообработке металлических деталей для керамических приборов и электронных компонентах.

Карбид кремния применяется в качестве абразива, что обусловлено высокой прочностью и низкой стоимостью химического соединения. При абразивной обработке этот материал используется в следующих процессах:
- шлифование;
- ламинирование бумажных изделий;
- пескоструйная обработка;
- хонингование;
- водоструйная резка.
Карборунд нашел широкое применение в производстве конструкционных материалов. Он обладает стойкостью к физическим нагрузкам и активно используется при изготовлении пуленепробиваемых жилетов и дисковых тормозов, устанавливаемых на транспортном средстве. С 1990-х гг. из карборунда изготавливают прочные газовые турбины. Они устойчивы к высоким температурам и ударным нагрузкам.
Физико-химические свойства камня
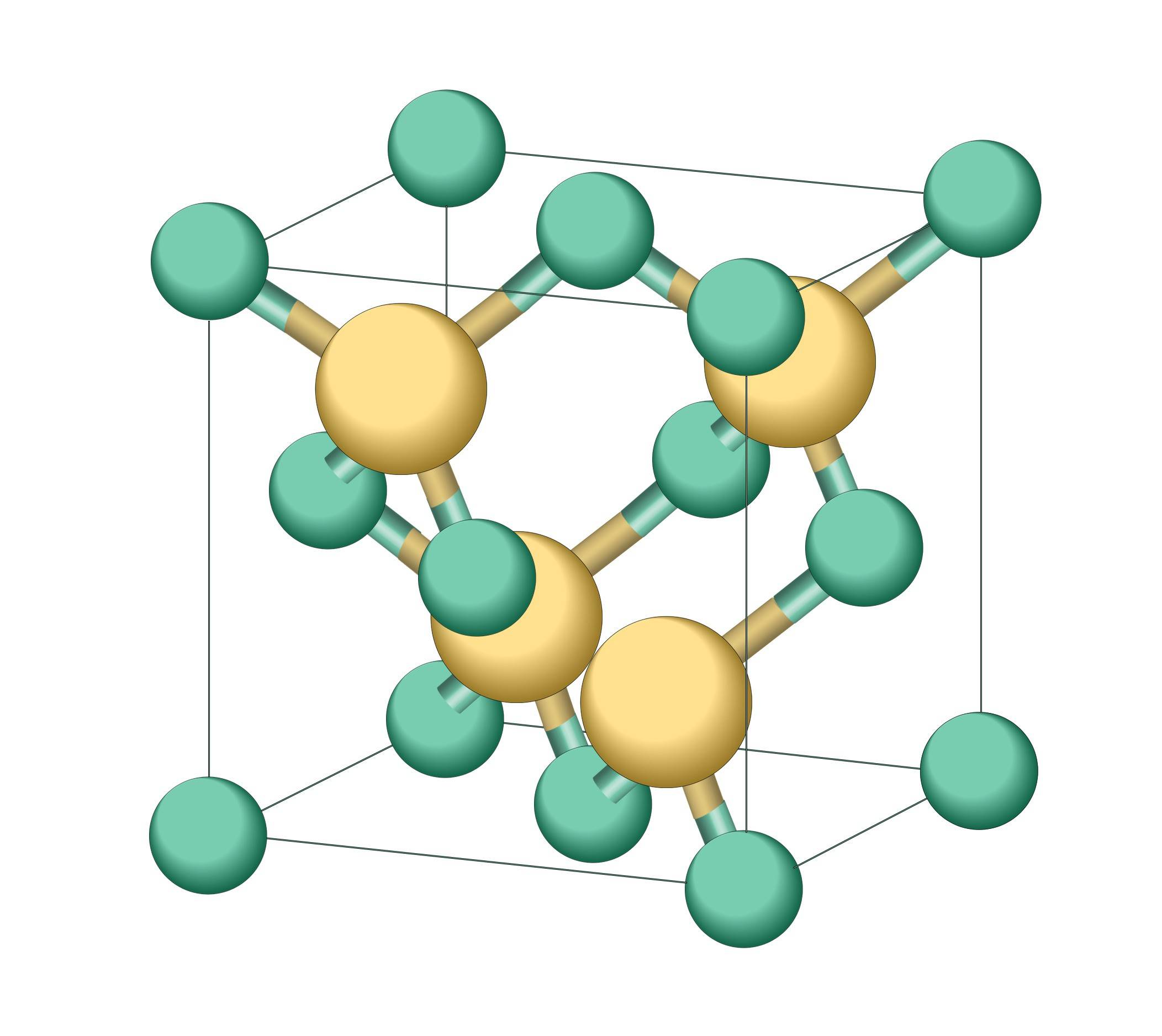
Химическая формула: SiC
Состояние: кристаллы, друзы или кристаллические порошки от прозрачного белого, жёлтого, зелёного или тёмно-синего до чёрного цветов, в зависимости от чистоты, дисперсности, аллотропных и политипных модификаций.
Температура плавления: 2830°C
Карбид кремния
- Плотность 3,05 г/см³
- Состав 93 % карбида кремния
- Предел прочности на изгиб 320…350 МПа
- Предел прочности на сжатие 2300 МПа
- Модуль упругости 380 ГПа
- Твердость 87…92 HRC
- Трещиностойкость в пределах 3.5 — 4.5 МПа·м1/2,
- Коэффициент теплопроводности при 100 °C, 140—200 Вт/(м·К)
- Коэфф. теплового расширения при 20-1000 °C, 3,5…4,0 К−1⋅10−6
- Вязкость разрушения 3,5 МПа·м1/2
Самосвязанный карбид кремния
- Плотность 3,1 г/см³
- Состав 99 % карбида кремния
- Предел прочности на изгиб 350—450 МПа
- Предел прочности на сжатие 2500 МПа
- Модуль упругости 390—420 ГПа
- Твердость 90…95 HRC
- Трещиностойкость в пределах 4 — 5 МПа·м1/2,
- Коэффициент теплопроводности при 100 °C, 80 — 130 Вт/(м·К)
- Коэфф. теплового расширения при 20-1000 °C, 2,8…4 К−1⋅10−6
- Вязкость разрушения 5 МПа·м1/2

ВК6ОМ
- Плотность 14,8 г/см³
- Состав Карбид вольфрама
- Предел прочности на изгиб 1700…1900 МПа
- Предел прочности на сжатие 3500 МПа
- Модуль упругости 550 ГПа
- Твердость 90 HRA
- Трещиностойкость в пределах 8-25 МПа·м1/2,
- Коэффициент теплопроводности при 100 °C, 75…85 Вт/(м·К)
- Коэфф. теплового расширения при 20-1000 °C, 4,5 К−1⋅10−6
- Вязкость разрушения 10…15 МПа·м1/2
Силицированный графит СГ-Т
- Плотность 2,6 г/см³
- Состав 50 % карбида кремния
- Предел прочности на изгиб 90…110 МПа
- Предел прочности на сжатие 300…320 МПа
- Модуль упругости 95 ГПа
- Твердость 50…70 HRC
- Трещиностойкость в пределах 2-3 МПа·м1/2,
- Коэффициент теплопроводности при 10 °C, 100…115 Вт/(м·К)
- Коэфф. теплового расширения при 20-1000 °C, 4,6 К−1⋅10−6
- Вязкость разрушения 3…4 МПа·м1/2
Сфера применения
Древесный уголь используется в промышленности в следующих целях:
- для применения в составе фильтров;
- для плавки кристаллического кремния;
- для использования в металлургии (насыщение стали углеродом, получение чистых сплавов);
- для производства стекла, некоторых видов пластмасс, красок;
- для изготовления натурального красителя для пищевой промышленности;
- для изготовления активированного угля;
- для использования в сельском хозяйстве;
- для применения в качестве удобного бытового топлива для печей, каминов, мангалов.
При сжигании в печах и каминах данный вид топлива сгорает практически без языков пламени, обеспечивая ровный и интенсивный жар. Наиболее высоко ценится продукт марки А, который изготавливается из твердых пород древесины.
Применение карбида кремния
Карборунд используется при производстве полупроводниковой продукции, поскольку имеет высокую теплопроводность и плотность электротока. Его твердость делает из карбида кремния отличный абразив, который применяют для шлифовки, пескоструйной обработки, хонингования.
Карбид кремния можно встретить:
- в ювелирных цехах;
- в строительстве;
- в ядерной энергетике;
- в оборонной промышленности (в частности, для изготовления бронежилетов);
- в автомобилестроении (для дисковых прочных тормозных систем);
- в изготовлении мощной оптики и высокотемпературных печей;
- и так далее.
Работникам, контактирующим с карборундом, не обойтись без средств индивидуальной защиты, ведь искусственному минералу присвоен 4-й класс опасности. При контакте он способен нанести вред здоровью человека.
При соблюдении техники безопасности карбид кремния становится ключевым компонентом многих высокотехнологичных изделий. Объемы применения карборунда растут с каждым годом вместе с развитием промышленности в Российской Федерации и во всем мире.
Лабораторные исследования

В 1822 году в свободном состоянии SiO2 впервые был получен Берцелиусом. В лабораторных условиях аморфный кремний можно получить при нагревании химической смеси, состоящей из диоксида и металлического магния. Для проведения этого опыта компоненты должны быть тщательно измельчены. Под воздействием высоких температур можно наблюдать бурную реакцию. Если всё сделать правильно, то в итоге можно получить аморфный кремний: SiO2 + 2Mg → Si + 2MgO.
В лабораторных условиях также есть возможность задействовать оксид алюминия. Например: 3SiO2 + 4Al → 3Si + 2Al2O3. В промышленных целях использовать дорогостоящий магний и алюминий неэффективно. По этой причине спрос получили более доступные варианты:
- В электрических печах можно коксом восстановить необходимое химическое вещество из оксида. Например: SiO2 + 2С → Si + 2CO. Но во время химической реакции образуется загрязнённое вещество, а всё из-за наличия примесей карбидов кремния. По этой причине SiO2 не может использоваться для производства микросхем.
- Чистый кремний можно получить при условии разложения силана. Химическая формула: SiH4 → Si + 2H2.
- Наиболее чистый SiO2 можно получить в том случае, если прибегнуть к восстановлению тетрахлорида кремния с помощью водорода и высокой температуры (от +1200°C). Но также можно задействовать цинк: SiCl4 + 2Zn → Si + 2ZnCl2.
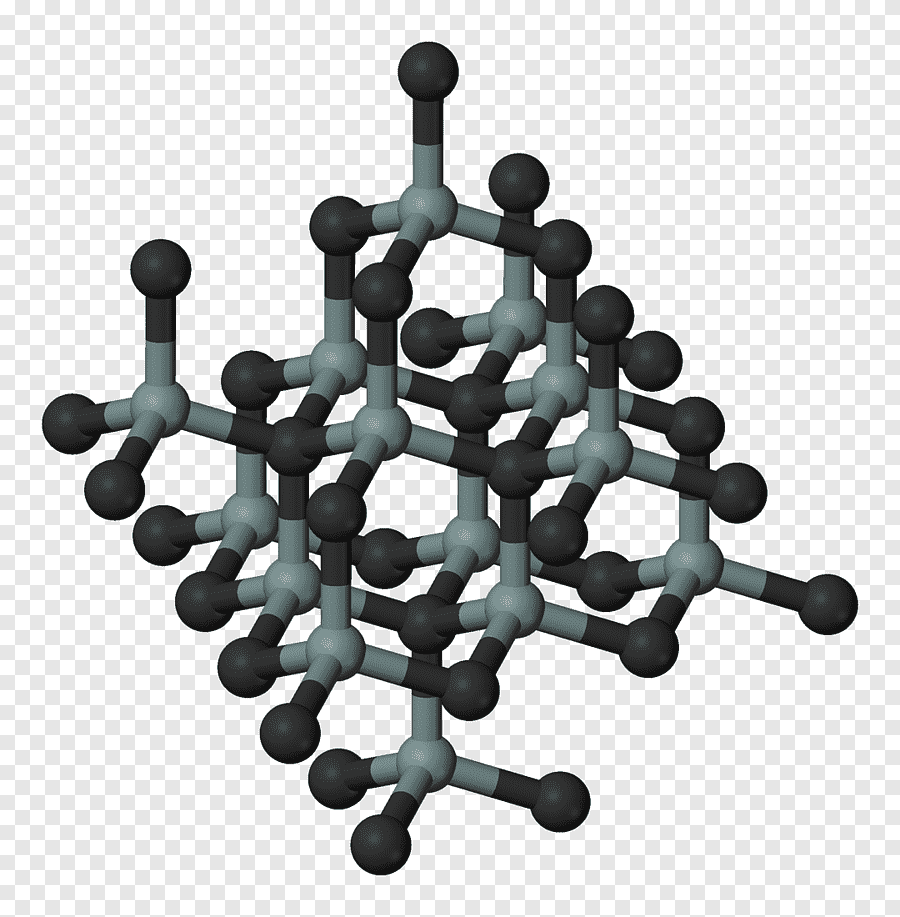
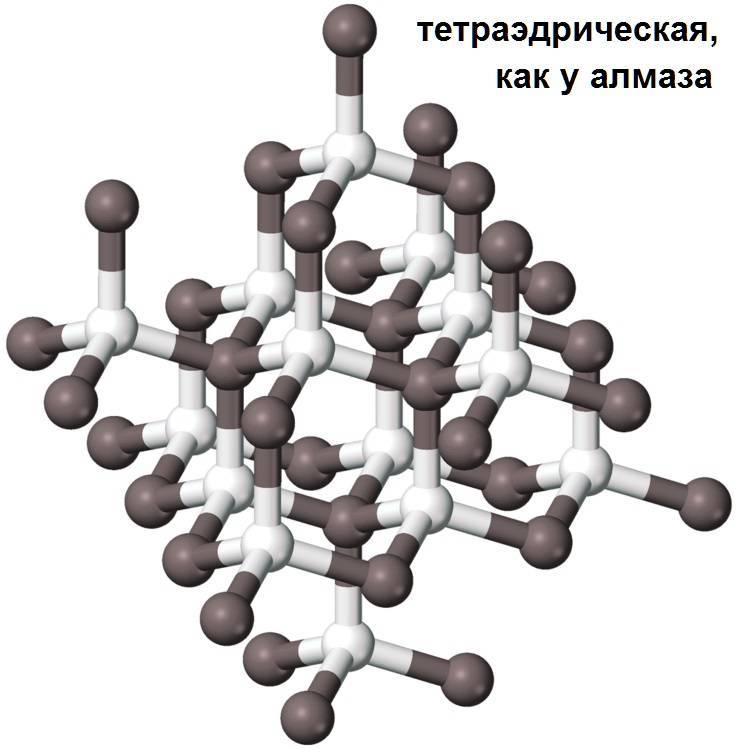
Карбид кремния (карборунд)
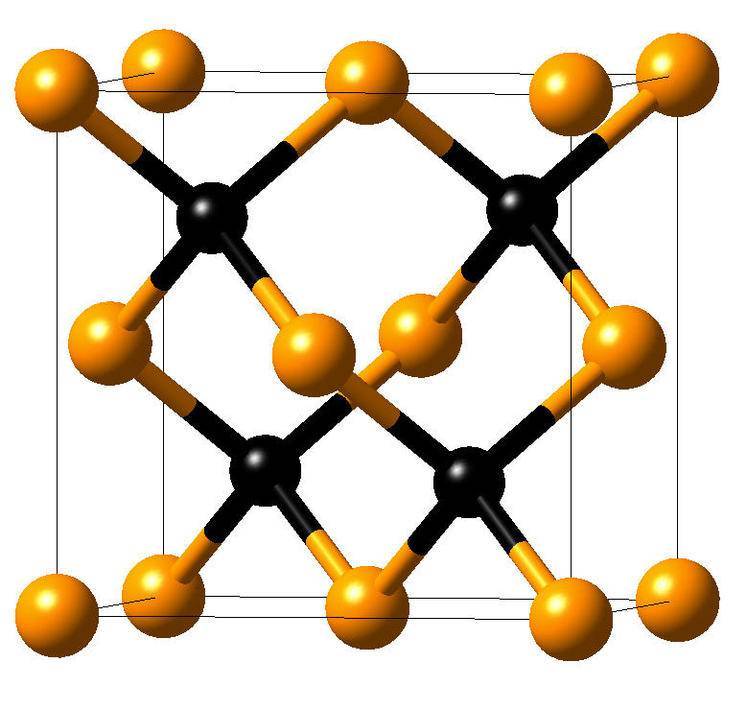
В химическом отношении Кремний, особенно кристаллический, малоактивен; при комнатной температуре он непосредственно соединяется только с Фтором. При нагревании Аморфный кремний легко соединяется с Кислородом, галогенами и Серой. Если накаливать в электрической печи смесь песка и кокса, взятых в определенном соотношении, то получится соединение Кремния с Углеродом – карбид кремния SiC, называемый карборундом.
Из порошка карборунда изготовляют шлифовальные круги, бруски, шлифовальную бумагу. На его основепроизводят плиты для сооружения полов, платформ и переходов в метро и на вокзалах. Из него готовят муфели и футеровку для различных печей. Смесь порошков карборунда и Кремния служит материалом для изготовления силитовых стержней для электрических печей.
Химически это карбид кремния. Это кристалл, который обладает сильными сегнетоэлектрическими свойствами и благодаря этому широко применяется в качестве различных пьезодатчиков и пъезоэлементов. В каждом доме в сво время была радиола, в качестве звукоснимателя для проигрывания пластинок в которой применялась именно игла из карборунда.
Из порошка карборунда изготовляют шлифовальные круги, бруски, шлифовальную бумагу
Карборунд, имеющий достаточно высокую тврдость по шкале Модса ( кажется около 7), применяется также и для целей различной механобработки (есть сврла, покрытые поршком карборунда, или, например, диски для резки стекла, не удивлюсь если он и на бакелитовые диски для обычных УШМ наносится.
Карборунд сравнительно термостоек, поэтому применяется в качестве несущих конструкций при высокой температуре в изделиях типа печей или испытательных стендов для авиатурбин. Применяется и просто как строительный материал, когда требуется создание фундамента со спецтребованиями (скажем. для установки оптико-механического оборудования типа телескопов, прецезонных обрабатывющих центров и т. п. ) так как спец. строительные материалы с ним дают малую усадку и изолируют вибрацию. Ипоследнее, что прочел, набрав “карборунд “в интернете. Разработаны на основе карборундовых пьезоэлементов “Звучащие полы” для дискотек. “Звучащие полы”-далеко не новость, в Бангкоке сам был в н. клубе на подобной дискотеке, но про карборундовые полы слышу впервые .
Структура и свойства
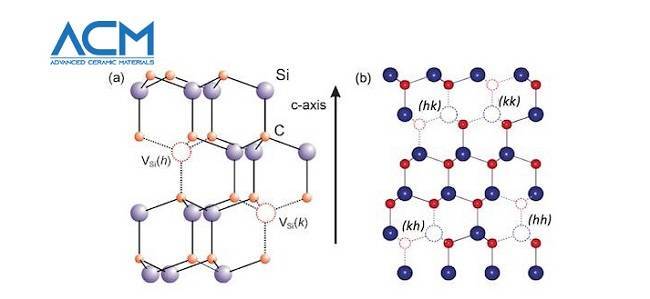
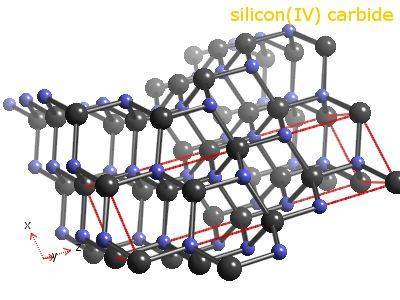
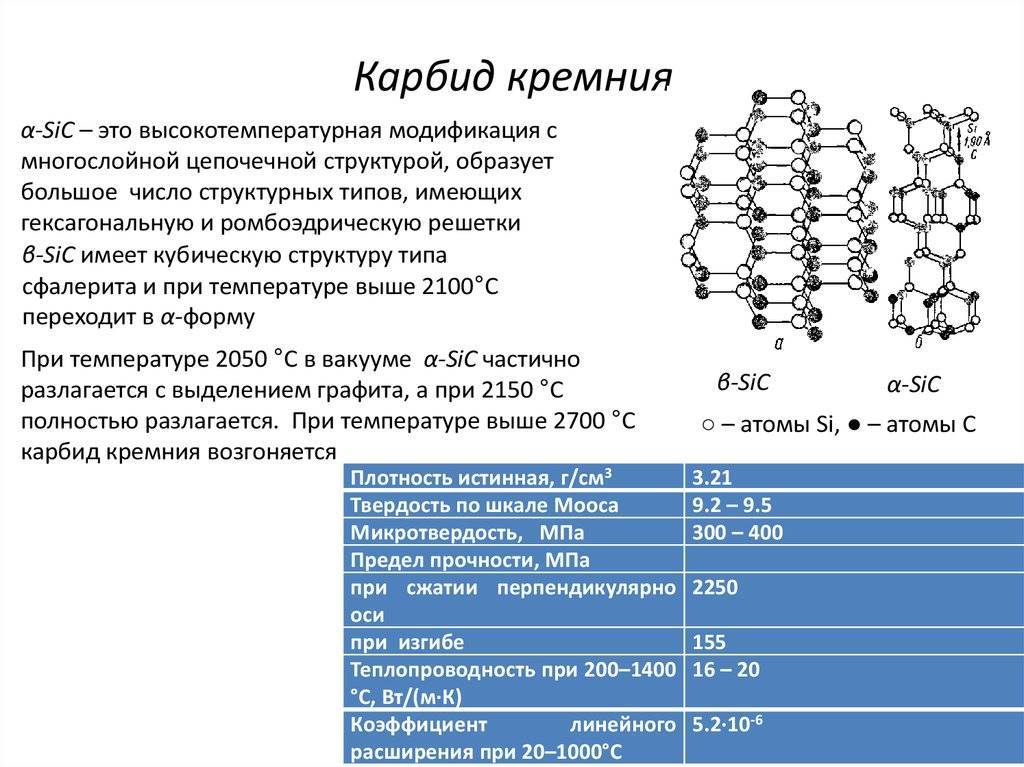
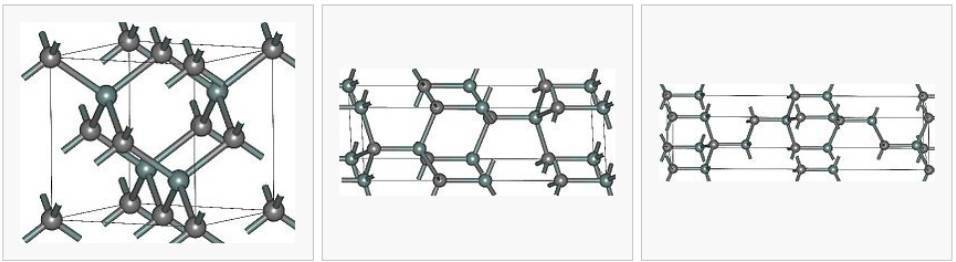
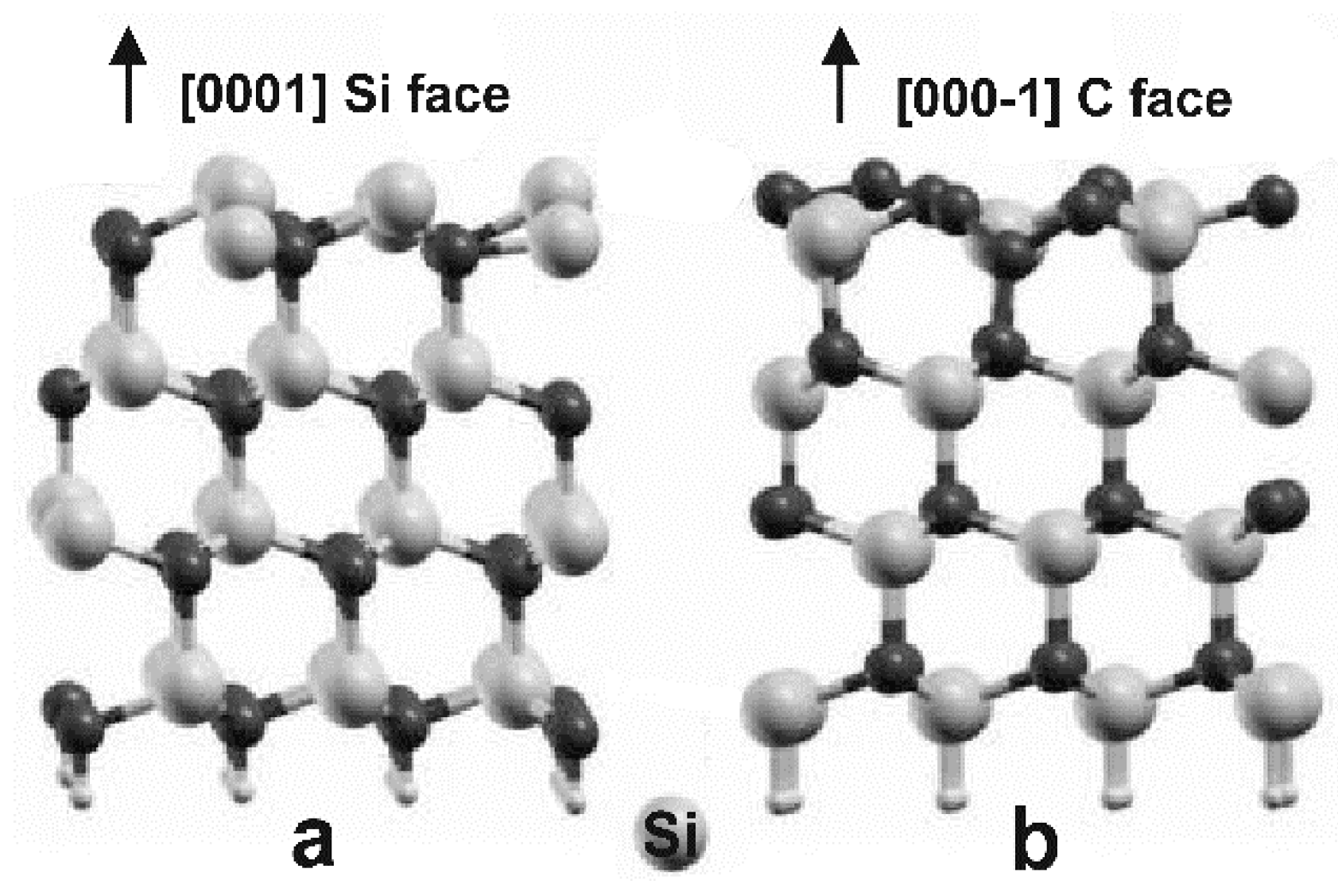
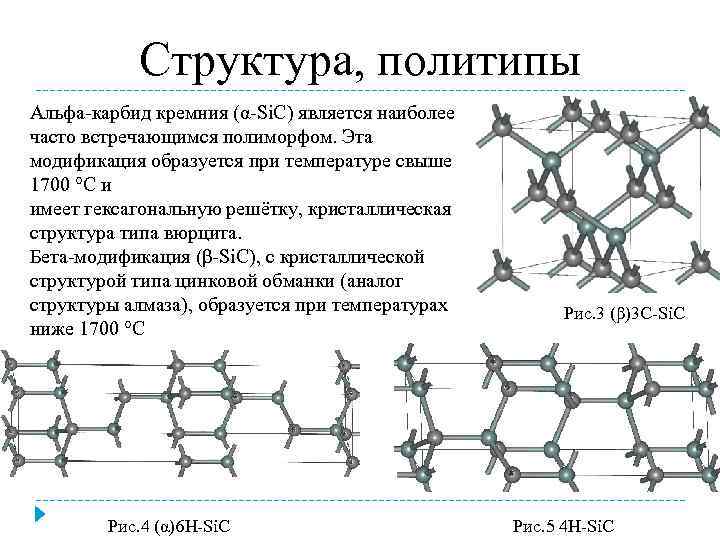
Известно примерно 250 кристаллических форм карбида кремния. Полиморфизм SiC характеризуется большим количеством схожих кристаллических структур, называемых политипами. Они являются вариациями одного и того же химического соединения, которые идентичны в двух измерениях, но отличаются в третьем. Таким образом, их можно рассматривать как слои, сложенные в стопку в определённой последовательности.
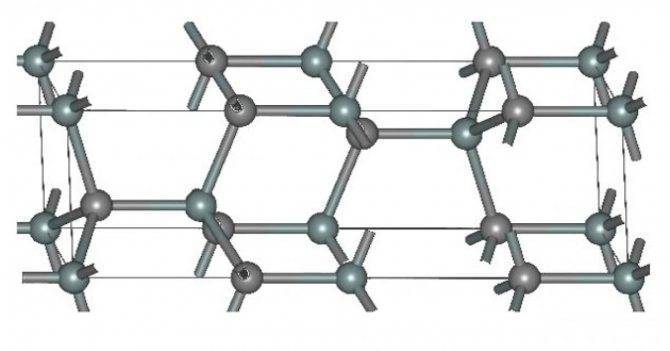
Альфа-карбид кремния (α-SiC) является наиболее часто встречающимся полиморфом. Эта модификация образуется при температуре свыше 1700 °C и имеет гексагональную решётку, кристаллическая структура типа вюрцита.
Краткое описание
Оксид кремния (IV) SiO2 представляет собой твёрдое, тугоплавкое кристаллическое вещество, которое не растворяется в воде и не вступает с ней в реакцию. Химический компонент проявляет окислительные свойства. При температуре от +1000°C SiO2 взаимодействует с активными металлами. В этом случае образуется кремний:
- SiO2 + 2Mg = Si + 2MgO.
- 3SiO2 + 4Al = 3Si + 2Al2O3.
При избытке кремния происходит восстановление силицидов. Эта химическая реакция имеет следующую формулу: SiO2 + 4Mg = Mg2Si + 2MgO. Силициум взаимодействует с водородом, а при использовании углерода образуется карборунд: SiO2 + 3C = SiC + 2CO.
Если попробовать сплавить оксид кремния со щелочами, то в итоге можно будет получить силикаты:
- SiO2 + 2NaOH = Na2SiOO3 + H2O.
- SiO2 + CaO = CaSiO3.
- SiO2 + K2CO3 = K2SiO3 + CO2.
- SiO2 + H2O ≠.
При нормальном давлении и температуре воздуха можно выделить три кристаллические модификации SiO2: тридимит, кварц и кристобалит. В каждом случае известны высокотемпературные и низкотемпературные формы. В их основе лежат тетраэдры SiO4, которые соединены четырьмя атомами кислорода в трёхмерной решётке.
Свойства монооксида

На уроках химии можно узнать, что формула оксида кремния выглядит следующим образом — SiO2. Внешне это вещество имеет вязкую консистенцию, больше напоминает смолу. Без какого-либо воздействия оксид кремния отлично сохраняет своё конденсированное состояние, не подвержен окислению. SiO2 не влияет на образование солей, а также не пропускает ток. Получить монооксид кремния можно двумя доступными методами:
- Нагреть кремний до отметки +400°C и выше при недостаточном объёме кислорода. Формула выглядит следующим образом: 2Si + O2 → 2SiO.
- Использование специального метода Чохральского (выращивание монокристаллов путём вытягивания их вверх от свободной поверхности большого объёма расплава) при восстановлении диоксида в условиях высоких температур. Формула: 2SiO2 + Si → 2SiO.
В твёрдом состоянии монооксид представляет собой порошок коричневого цвета. Это химическое вещество обладает высокой прочностью и инертностью при условии взаимодействия с кислотами. Добиться полного растворения монооксида можно только в плавиковой кислоте. Среди основных химических свойств SiO2 можно выделить:
- Монооксид может разлагаться только под воздействием высоких температур. Отобразить эту реакцию можно с помощью следующей формулы: 2SiO → 2Si + О2.
- При нагревании монооксид взаимодействует с СО2. Формула: SiO + CO2 → SiO2 + CO.
- Монооксид кремния вступает в реакцию с парами Н2О, но только при условии нагревания до +500°C. Этот процесс хорошо виден в формуле: SiO + H2O → SiO2 + H2.
- Жидкий хлорид кремния можно получить в том случае, если дополнительно задействовать хлор и нагреть смесь до +800°C. Наглядно эта реакция выглядит так: 2SiO + 4Cl2 → 2SiCl4 + O2.
Характеристика диоксида
Оксид кремния (SiO2) представляет собой кристаллическое тугоплавкое вещество, которое не растворяется в воде. Этот химический компонент не проводит электрический ток. На уроках химии в 8 классе учащимся объясняют, что диоксид входит в состав следующих горных пород:

- Песка.
- Горного хрусталя.
- Яшмы.
- Кварца.
- Агата.
- Аметиста.
Литосфера на 87% состоит из диоксида. Это химическое вещество имеет немолекулярное строение. Атомы кислорода и кремния связаны ковалентным способом. Благодаря этому сформировалась кристаллическая решётка. Диоксид можно получить в лабораторных условиях. Для этого кремний вместе с кислородом нагревают до отметки +500°C: Si + O2 → SiO2.
После воздействия кислот на растворимые силикаты образуется диоксид. В итоге формируется кремниевая кислота, которая распадается на диоксид и воду. Химическая реакция выглядит следующим образом:
- Na2 SiO3 + 2CH3COOH → 2CH3COONa + H2SiO3↓.
- H 2SiO3 → H2O + SiO2.
В нормальных условиях диоксид вступает в реакцию только с плавиковой кислотой. А вот с основными оксидами и щелочами может взаимодействовать только при воздействии высоких температур. Диоксид не реагирует на Н2О. Сегодня это химическое вещество используется для серийного производства силикагеля, стекла и бетона.
Методы получения SiC[править | править код]
Простейшим способом производства является спекание кремнезема с углеродом в графитовой электропечи Ачесона при высокой температуре 1800—2300 °C из смеси кварцевого песка (51—55%), кокса (35—40%) с добавкой NaCI (1—5%) и древесных опилок (5—10%).
SiO2+3C→1600−2500oCSiC+2CO~\mathsf{SiO_2 + 3C \xrightarrow{1600-2500^oC} SiC + 2CO}
Чистота карбида кремния, образующегося в печи Ачесона, зависит от расстояния до графитового электрода в печи. Кристаллы высокой чистоты бесцветного, бледно-жёлтого и зелёного цвета находятся ближе всего к электроду. С увеличением расстояния от электрода цвет изменяется на синий или черный из-за присутствия примесей.
Сложно получать сверхчистые кристаллы SiC. Из-за высоких значений температуры и давления, при которых существует расплав карбида кремния, классические методы получения из него монокристаллов не применимы.
Используют методы выращивания кристаллов SiC из газовой фазы или из растворов в расплаве. Большое распространение получил метод сублимации. В этом методе рост кристаллов карбида кремния происходит из газовой фазы в графитовых тиглях в атмосфере инертных газов при температуре 2500-2600 °C. Эпитаксиальные слои и твердые растворы на основе карбида кремния можно получать всеми известными методами, используемыми в полупроводниковой технологии. Технология формирования структур карбида кремния на подложках кремния принципиально не отличается от процессов получения кремниевых пленок. Гетероэпитаксиальные слои выращиваются методом газофазной эпитаксии в открытой системе. В качестве газа-носителя используется водород диффузионной очистки; в первой зоне свободный углерод связывается с водородом и переносится в зону роста полупроводниковой пленки.
Сфера применения
Древесный уголь используется в промышленности в следующих целях:
- для применения в составе фильтров;
- для плавки кристаллического кремния;
- для использования в металлургии (насыщение стали углеродом, получение чистых сплавов);
- для производства стекла, некоторых видов пластмасс, красок;
- для изготовления натурального красителя для пищевой промышленности;
- для изготовления активированного угля;
- для использования в сельском хозяйстве;
- для применения в качестве удобного бытового топлива для печей, каминов, мангалов.
При сжигании в печах и каминах данный вид топлива сгорает практически без языков пламени, обеспечивая ровный и интенсивный жар. Наиболее высоко ценится продукт марки А, который изготавливается из твердых пород древесины.
В виде структурированной керамики
– В процессе, известном как спекание, частицы карбида кремния, а также частицы сопутствующих частиц нагреваются до температуры ниже, чем температура плавления этой смеси. Таким образом, он увеличивает сопротивление и прочность керамического объекта, образуя прочные связи между частицами.
– Конструкционная керамика из карбида кремния находит широкое применение. Они используются в дисковых тормозах и сцеплениях автомобилей, в сажевых фильтрах и в качестве присадки к маслам для уменьшения трения.
– Использование конструкционной керамики из карбида кремния стало широко распространенным в деталях, подвергающихся воздействию высоких температур. Например, это горловина форсунок ракет и ролики печей.
– Сочетание высокой теплопроводности, твердости и стабильности при высоких температурах делает детали трубок теплообменников изготовленными из карбида кремния.
– Конструкционная керамика используется в форсунках для пескоструйной обработки, уплотнениях автомобильных водяных насосов, подшипниках и пресс-формах. Это также материал для тиглей, используемых при плавке металлов.
– Входит в состав нагревательных элементов, используемых при выплавке стекла и цветных металлов, а также при термической обработке металлов.
Свойства атома кремния:
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса)* | 28,084-28,086 а.е.м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 2s2 2p6 3s2 3p2 |
| 203 | Электронная оболочка | K2 L8 M4 N0 O0 P0 Q0 R0 |
| 204 | Радиус атома (вычисленный) | 111 пм |
| 205 | Эмпирический радиус атома * | 110 пм |
| 206 | Ковалентный радиус | 111 пм |
| 207 | Радиус иона (кристаллический) | Si4+ 40 (4) пм, 54 (6) пм (в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | 210 пм |
| 209 | Электроны, Протоны, Нейтроны | 14 электронов, 14 протонов, 14 нейтронов |
| 210 | Семейство (блок) | элемент p-семейства |
| 211 | Период в периодической таблице | 3 |
| 212 | Группа в периодической таблице | 14-ая группа (по старой классификации – главная подгруппа 4-ой группы) |
| 213 | Эмиссионный спектр излучения |  |