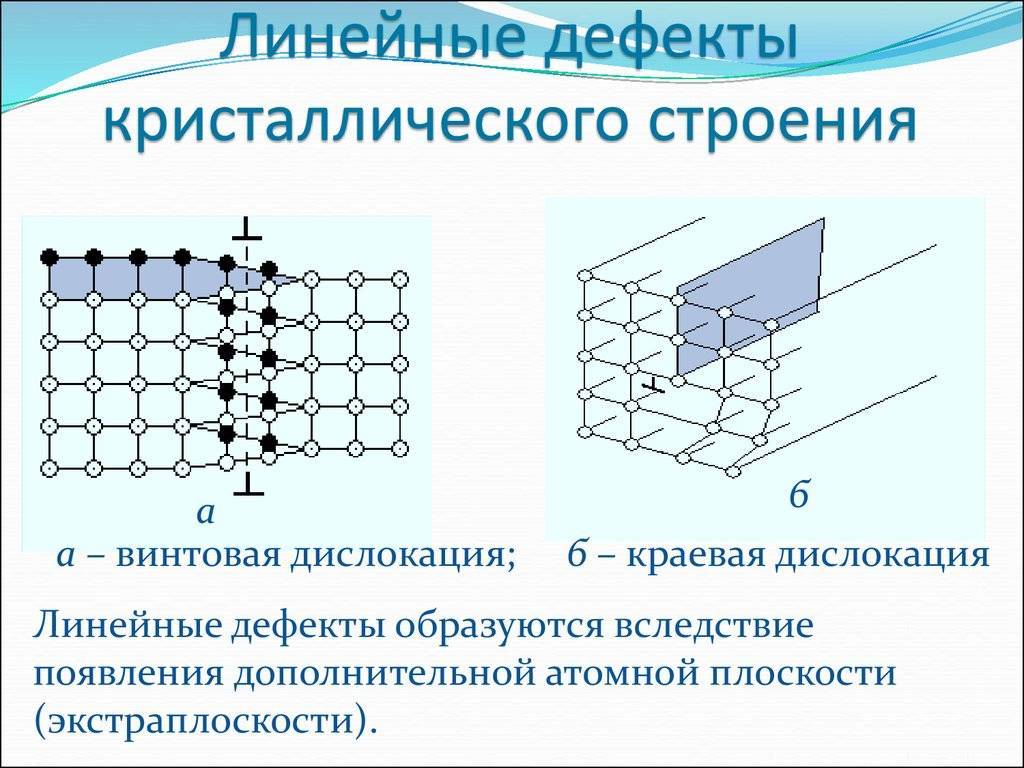
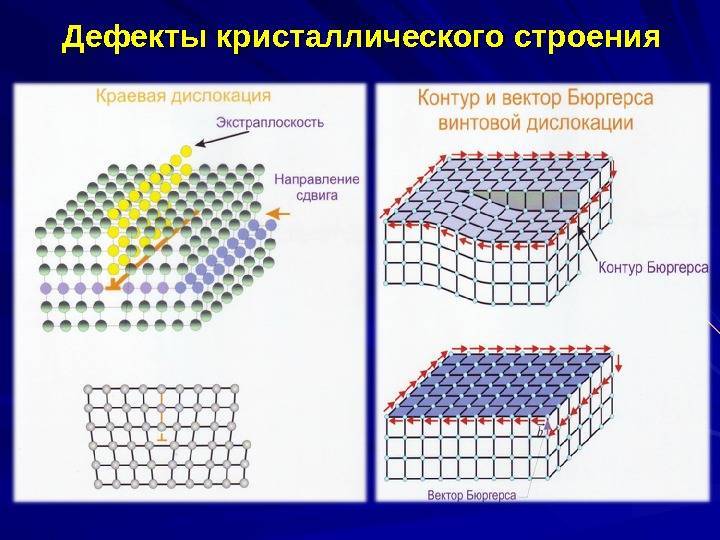
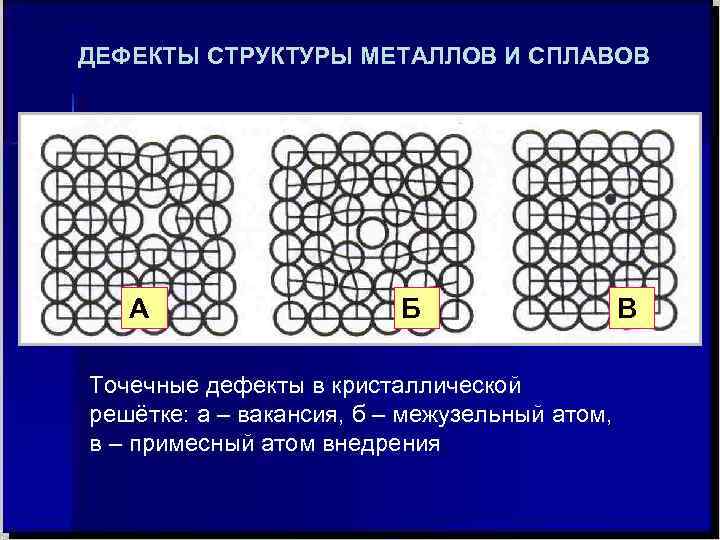
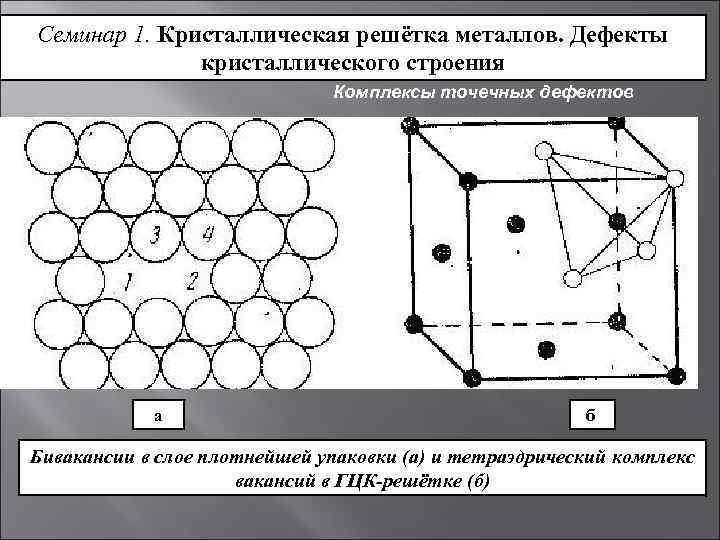
Кристаллическое строение сплавов
Сплав это материал, состоящий из двух и более химических элементов. В его состав могут входить как металлы, так и неметаллы. Например, бронза — это сплав меди и олова, а чугун — сплав железа и углерода. Кроме основных, в состав могут входить и другие вещества, содержащиеся в небольших количествах. Если их добавляют специально и улучшают свойства материала, их называют легирующими присадками, если ухудшают — вредными примесями. Кристаллическое строение сплавов сложнее, чем металлов.

Строение сплавов
Оно определяется взаимовлиянием компонентов при образовании кристалла, и принадлежит к трем подвидам:
- Твердые растворы. Один элемент растворяется в другом. Ведущий элемент строит кристаллическую структуру, а атомы второстепенного элемента размещаются в объеме этой решетки.
- Химическое соединение. Элементы химически реагируют друг с другом, образуя новое соединение. Из его молекул и составляется кристаллическая решетка.
- Механическая смесь. Элементы сплава не реагируют друг с другом. Каждый строит свои кристаллические структуры, срастающиеся в независимые кристаллы. Сплав будет представлять собой затвердевшую смесь из множества кристалликов двух разных типов. Такое вещество будет иметь собственную температуру перехода в жидкую фазу.
Что такое перлит и эвтектоид
Наблюдения показывают, что этот переход происходит следующим образом: по достижении температур GS по границам Наблюдения показывают, что этот переход происходит следующим образом : по достижении температур GS по границам аустенитовых кристаллов выделяются первые порции α — Fe, т. е. феррита, количество которого постепенно увеличивается.
Так как феррит почти не растворяет углерода, то при переходе γ-Fe -> α-Fe концентрация углерода в остаточном аустените постепенно увеличивается и может быть определена по линии G S в зависимости от температуры. Процесс выделения феррита протекает так до тех пор, пока концентрация углерода не будет соответствовать точке 5, т. е. до С=0,83%, а температура не достигнет t=723°.
В точке S кривая GS пересекается с ES — кривой предельной растворимости углерода в аустените. Поэтому дальнейшее насыщение остаточного аустенита углеродом становится уже невозможным, и последующее охлаждение вызывает окончательный распад аустенита, который совершается при постоянной температуре t=723°.
При этом распаде завершается переход γ- Fe->α-Fe, а выделившийся из кристаллической решетки железа углерод образует частицы цементита F3C. Распад аустенита происходит в стесненном объеме в пределах каждого зерна, поэтому продукты распада (феррит и цементит) образуются в виде тесно перемешанных частиц, обычно в виде чередующихся пластинок феррита и цементита.
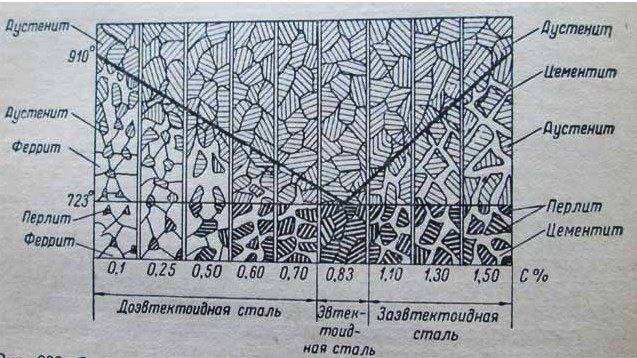
Схема изменений структуры сталей при переходе через критические точки
Этот продукт распада аустенита называется перлитом; так как перлит имеет строение, подобное эвтектике, то он называется эвтектоидом. Разница между эвтектикой и эвтектоидом заключается в том, что эвтектика образуется из жидкого раствора, а эвтектоид — из твердого.
Образование перлита начинается и заканчивается при постоянной t=723°. Так ппявляется феррито-перлитовая структура сталей, которая при дальнейшем охлаждении от t=723° не претерпевает больше никаких структурных изменений. На рисунке представлены микроструктуры чистого железа и стали при С =0,15% и при С=0,6% (увеличение 100) после травления по-шрованной поверхности микрошлифа 4% раствором HNO3 в этиловом спирте.
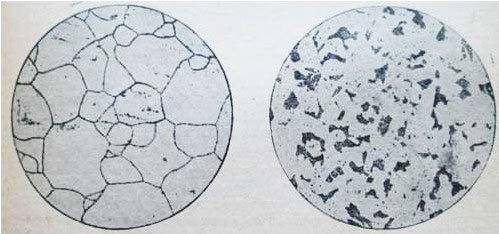
Рис. 1. — феррит в чистом железе. Рис. 2 Доэвтектоидная сталь с содержанием С=0,15%
На рис. 1, где показана микроструктура чистого железа, четко выявились границы между светлыми зернами феррита. На рис. 2 представлена микроструктура строительной стали (С=0,15%); светлые поля — это феррит, темные участки — перлит. На рис. 3 приведена микроструктура машиностроительной стали (С=0,6%), из которой изготовляют оси, валы, шатуны и т. п.; большая часть шлифа занята перлитом, а феррит наблюдается только в виде тонкой сетки. Чем больше углерода, тем больше в структуре стали перлита, состав перлита одинаков (С=0,83%). Строение перлита обычно пластинчатое (рис. 4).

Рис. 3 Доэвтектоидная сталь с содержанием С=0,6%. Рис. 4 Эвтектоидная сталь (пластинчатый перлит).
Феррит, как было указано выше, представляет собой наиболее мягкую пластичную составляющую железоуглеродистых сплавов; цементит, входящий в состав перлита, наиболее твердую и хрупкую, поэтому с увеличением содержания углерода увеличивается прочность и твердость стали, но пластичность и вязкость уменьшаются
Чтобы строительная сталь была достаточно пластичной, количество перлита в ней не должно превосходить 25%, что соответствует содержанию углерода до 0,2%.
В. тех деталях, от которых требуется большая прочность и твердость, но допустимы меньшая пластичность и вязкость (детали машин), применяются стали с большим количеством перлита, с содержанием С до 0,6%. В строительном деле такие стали применяются, например, для изготовления лопат, опорных частей мостовых ферм.
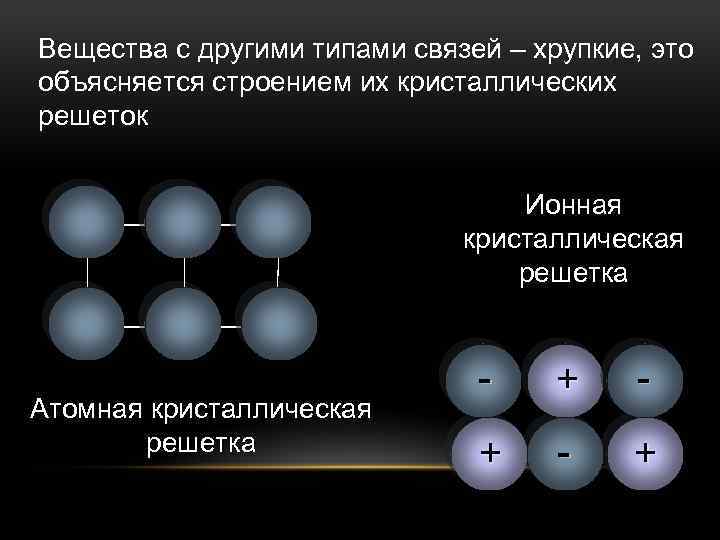
Ионная кристаллическая решетка

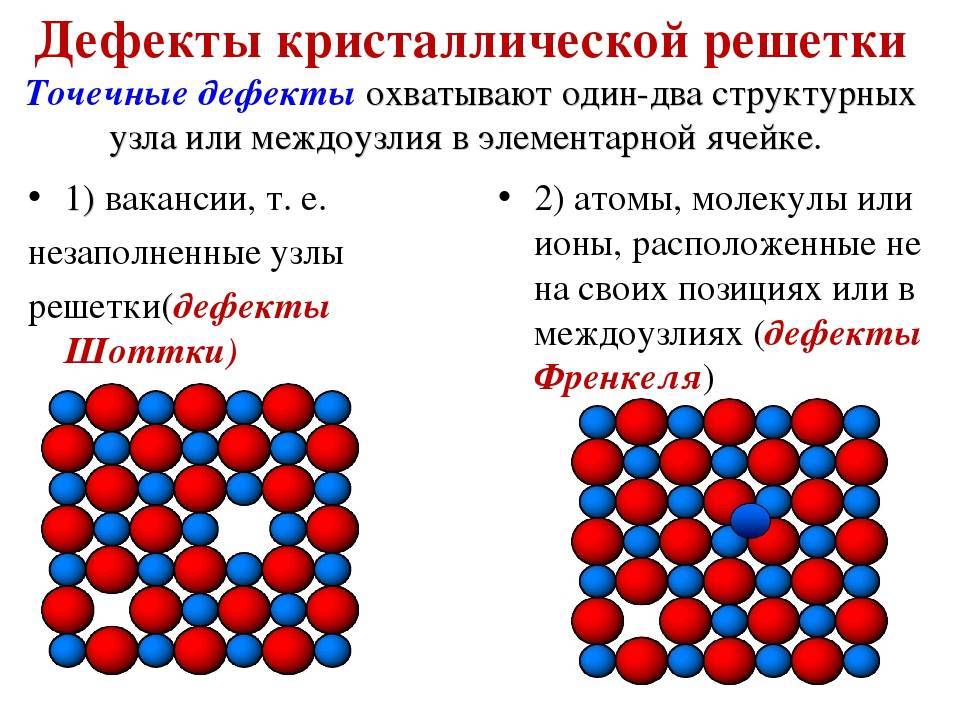
В случае, если в узлах кристалла находятся заряженные частицы – ионы, мы можем говорить о ионной кристаллической решетке. Как правило, с ионных кристаллах чередуются положительные ионы (катионы) и отрицательные ионы (анионы), поэтому частицы в кристалле удерживаются силами электростатического притяжения. В зависимости от типа кристалла и типа ионов, образующих кристалл, такие вещества могут быть довольно прочными и тугоплавкими. В твердом состоянии подвижных заряженных частиц в ионных кристаллах, как правило, нет. Зато при растворении или расплавлении кристалла ионы высвобождаются и могут двигаться под действием внешнего электрического поля. Т.е. проводят ток только растворы или расплавы ионных кристаллов. Ионная кристаллическая решетка характерна для веществ с ионной химической связью. Примеры таких веществ – поваренная соль NaCl, карбонат кальция – CaCO3 и др. Ионную кристаллическую решетку, как правило, в твердой фазе образуют соли, основания, а также оксиды металлов и бинарные соединения металлов и неметаллов.
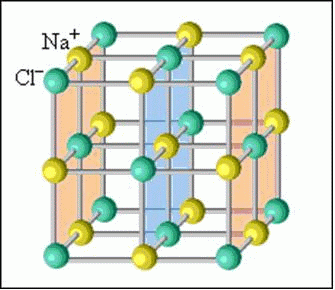
Связь между частицами в ионных кристаллах: ионная химическая связь.
В узлах кристалла с ионной решеткой расположены ионы.
Фазовое состояние ионных кристаллов при нормальных условиях: как правило, твердые вещества.
Химические вещества с ионной кристаллической решеткой:
- Соли (органические и неорганические), в том числе соли аммония (например, хлорид аммония NH4Cl);
- Основания;
- Оксиды металлов;
- Бинарные соединения, в составе которых есть металлы и неметаллы.
Физические свойства веществ с ионной кристаллической структурой:
— высокая температура плавления (тугоплавкость);
— растворы и расплавы ионных кристаллов – проводники тока;
— большинство соединений растворимы в полярных растворителях (вода);
— твердое фазовое состояние у большинства соединений при нормальных условиях.
Почему стоит заказать решетки на окна именно у нас
Компания «Стальной декор» уже 10 лет создает прочные и красивые металлические решетки для окон и устанавливает их в домах и офисах на всей территории Москвы и Московской области. Репутация для нас — это не просто слово. Мы настолько уверены в качестве своих изделий, что назначаем гарантийный срок для каждой металлической конструкции до 5 лет. Отдельное изделие проходит несколько этапов отбраковки, но последнее слово всегда за клиентом!
Если Вы живете на первом этаже или в собственном доме, то наверняка перед Вами периодически возникает вопрос: какие решетки установить на окна? Это необходимый элемент, который позволит Вам защитить свое имущество и защитить в случае необходимости Вашу семью. Именно поэтому, к выбору оконных решеток стоит подходить очень ответственно! Сегодня мы расскажем Вам, как правильно выбрать решетки на окна.
Кроме того, оконные решетки могут украсить и улучшить внешний вид Вашего дома или квартиры. Есть всего два основных вида решеток. Первый — это сварные решетки. В настоящее время ни пользуется популярностью именно этот вид решеток. Их преимущество в прочности и жесткости. Кроме того, цены на такие решетки ниже. Однако сварные решетки не отличаются особо привлекательным дизайном, поэтому не всем покупателям они нравятся.
Кованые решетки привлекают своим внешним видом. Они могут быть очень изящными и стильными. Однако стоимость таких решеток будет гораздо выше, поскольку каждая решетка делается индивидуально под заказ. Если у Вас есть финансы, то кованые решетки будут оптимальным вариантом.
По конструкции решетки бывают:
* из прутка с круглым или квадратным сечением (они наиболее крепкие, благодаря своей толщине от 12 до 20 мм);
* из полосы с прямоугольным сечением (этот профиль обойдется вам дешевле, однако будет отличаться меньшей надежностью).
Если Вы решили делать решетки на заказ, обратите внимание на материал
, из которого они будут изготовлены. Вы вполне можете заказать себе решетки на окна, изготовленные из сочетания двух конструкций. По типу монтажа решетки на окна мало чем различаются
Мастер лишь выбирает способ крепления, который зависит от особенностей изделия. Решетки могут быть стационарными, распашными, раздвижными или съемными. Все что Вам необходимо — это решить, какой вид решеток необходим в Вашем случае
По типу монтажа решетки на окна мало чем различаются. Мастер лишь выбирает способ крепления, который зависит от особенностей изделия. Решетки могут быть стационарными, распашными, раздвижными или съемными. Все что Вам необходимо — это решить, какой вид решеток необходим в Вашем случае.
Стационарные решетки крепятся раз и навсегда. Вы не сможете их открыть, и их конструкция максимально надежна. Процесс крепления:
* В торцах оконного проема нужно просверлить отверстия под крепления решетки. В зависимости от размеров креплений, диаметр отверстий может варьироваться от 12 до 20 мм.
* После этого решетка крепится ко всем четырем сторонам оконного проема с помощью специальных крюков-штырей, прижимающих металлическое изделие к стенам.
Распашные металлические решетки позволят Вам периодически их раскрывать, как створки. По желанию, Вы можете заказать решетки с одной или двумя подвижными створками. Процесс крепления такой же, какой был описан выше. Однако крепление решетки происходит только в боковых сторонах оконного проема.
Раздвижные решетки
имеют систему, похожую на систему раздвижного механизма
Процесс крепления:
* При монтаже нужно прикрепить полозы (направляющие шины решетки) к торцам оконного проема для свободного хода конструкции во время раздвигания, а после вставить решетку в созданную раму.
* Обратите внимание, что у раздвижных решеток есть свои недостатки: конструкция из склепанной крест-накрест полосы снижает защитные свойства и жесткость
И, наконец, съемные решетки монтируются в межоконный проем. Монтировать их можно как с помощью крюков, так и с использованием ввинчиваемых болтов.
Соли
Важным продуктом, содержащим щелочной металл, является сода Na2CO3. Основное количество соды во всём мире производят по методу Сольве, предложенному ещё в начале XX века. Суть метода состоит в следующем: водный раствор NaCl, к которому добавлен аммиак, насыщают углекислым газом при температуре 26—30 °C. При этом образуется малорастворимый гидрокарбонат натрия, называемый питьевой содой:
{\mathsf {NaCl+\ NH_{3}+\ CO_{2}+\ H_{2}O\longrightarrow \ NaHCO_{3}\downarrow +\ NH_{4}Cl)) Аммиак добавляют для нейтрализации кислотной среды, возникающей при пропускании углекислого газа в раствор, и получения гидрокарбонат-иона HCO3−, необходимого для осаждения гидрокарбоната натрия. После отделения питьевой соды раствор, содержащий хлорид аммония, нагревают с известью и выделяют аммиак, который возвращают в реакционную зону:
{\mathsf {2\ NH_{4}Cl+\ Ca(OH)_{2}\longrightarrow 2\ NH_{3}\uparrow +\ CaCl_{2}+2\ H_{2}O)) Таким образом, при аммиачном способе получения соды единственным отходом является хлорид кальция, остающийся в растворе и имеющий ограниченное применение.
При прокаливании гидрокарбоната натрия получается кальцинированная, или стиральная, сода Na2CO3 и диоксид углерода, используемый в процессе получения гидрокарбоната натрия:
{\mathsf {2\ NaHCO_{3}\longrightarrow \ Na_{2}CO_{3}+\ CO_{2}\uparrow +\ H_{2}O)) Основной потребитель соды — стекольная промышленность.
В отличие от малорастворимой кислой соли NaHCO3, гидрокарбонат калия KHCO3 хорошо растворим в воде, поэтому карбонат калия, или поташ, K2CO3 получают действием углекислого газа на раствор гидроксида калия:
{\mathsf {2\ KOH+\ CO_{2}\longrightarrow \ K_{2}CO_{3}+\ H_{2}O)) Поташ используют в производстве стекла и жидкого мыла.
Литий — единственный щелочной металл, для которого не получен гидрокарбонат. Причина этого явления в очень маленьком радиусе иона лития, который не позволяет ему удерживать довольно крупный ион HCO− 3.
Основные группы металлов в промышленности
Индустрия делит металлы на большие группы:
- Черные.
- Цветные легкие.
- Цветные тяжелые.
- Благородные.
- Редкоземельные и щелочные.
Черные металлы
В эту группу входят железо, марганец, хром и их сплавы. Группа также включает в себя стали, чугуны и ферросплавы. Эти вещества обладают хорошей электропроводностью и уникальными магнитными характеристиками.
Черные металлы
Легкие цветные металлы
Отличаются низкой плотностью. Группа включает в себя алюминий, титан, магний. Эти реже встречаются, чем железо, и обходятся дороже в добыче руды и в производстве. Они используются там, где малый вес изделия или детали окупает ее большую стоимость – в самолетостроении, производстве электроники, в коммуникационной индустрии.

Легкие цветные металлы
Титан не вызывает отторжения со стороны иммунной системы и применяется в протезировании костной ткани.
Тяжелые цветные металлы
Это элементы с большим удельным весом, такие, как медь, олово, свинец, цинк и никель. Обладают хорошей электропроводностью.
Медь Олово Цинк Свинец Чистый никель
Они широко используются как катализаторы реакций, в изготовлении электроматериалов, в электронике, на транспорте – везде, где требуются достаточно прочные, упругие и коррозионностойкие материалы.
Благородные металлы
В эту группу входят золото, серебро, платина, а также редко встречающееся рутений, родий, палладий, осмий, иридий. Они обладают наибольшим удельным весом, высокой коррозионной устойчивостью и высокой электрической и тепловой проводимостью.

Золото и платина

Серебро
На заре человечества золото, серебро и платина применялись как универсальный платежный инструмент и как средство накопления богатств. С развитием цифровой экономики и переходом платежей в виртуальность важнее стаи их уникальные физические свойства
Редкоземельные и щелочные
К редкоземельным относятся скандий, иттрий, лантан и еще 15 редких элементов. Эти элементы отличаются значительным удельным весом, высокой химической активностью и применяются в высокотехнологичных отраслях.

Иттрий

Сканидий

Лантан
К щелочным относятся литий, калий, натрий и другие. Все они отличаются малым удельным весом и исключительной химической активностью и при реакции с водой образуют щелочи, широко применяемы в быту и промышленности в составе мыла и других моющих средств.

Щелочные металлы
Черные и цветные металлы
Выше была приведена классификация рассматриваемых элементов в соответствии с их электронным строением и положением в периодической системе. Помимо нее, существует еще одно разделение, которое не связано с атомным строением — это понятие о черных и цветных металлах.
Черным является железо и все сплавы с его участием. Примеры цветных металлов — это алюминий, золото, серебро, медь и другие, а также сплавы, которые не содержат железа. Причина такого разделения проста, черные металлы являются дешевыми и недолговечными (разрушаются в результате коррозии, ржавеют). Наоборот, цветные металлы характеризуются способностью образовывать пленки оксидные, которые предотвращают основную массу материала от дальнейшего химического разрушения.
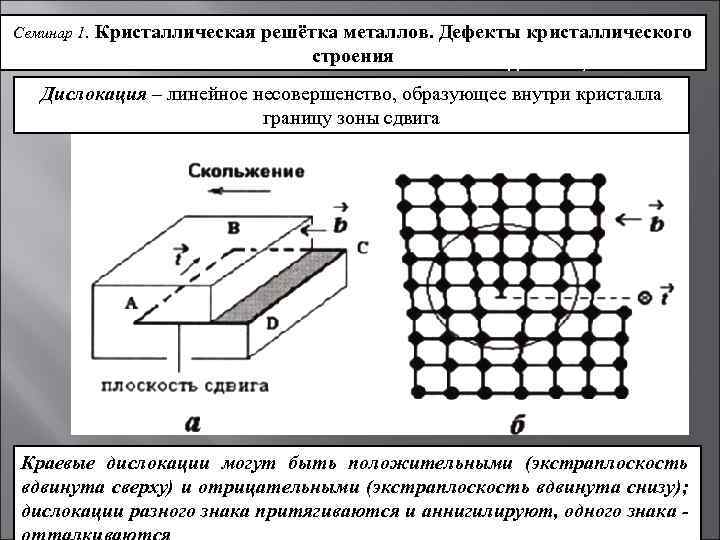
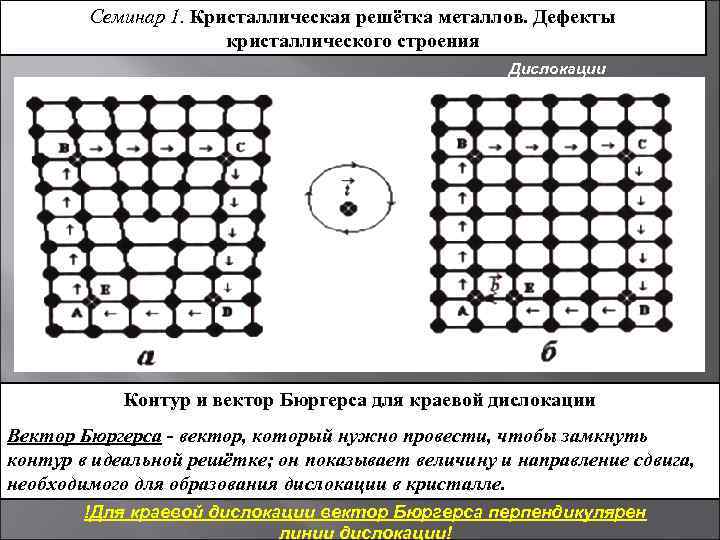
Наличие порядка в расположении частиц
В аморфном веществе, в отличие от кристаллического, отсутствует какой-либо порядок в расположении частиц. Если же в кристаллическом веществе мысленно соединить прямой два близкоросположенных друг к другу атома, то можно обнаружить, что на этой линии на строго определенных промежутках будут лежать одни и те же частицы:
Таким образом, в случае кристаллических веществах можно говорить о таком понятии, как кристаллическая решетка.
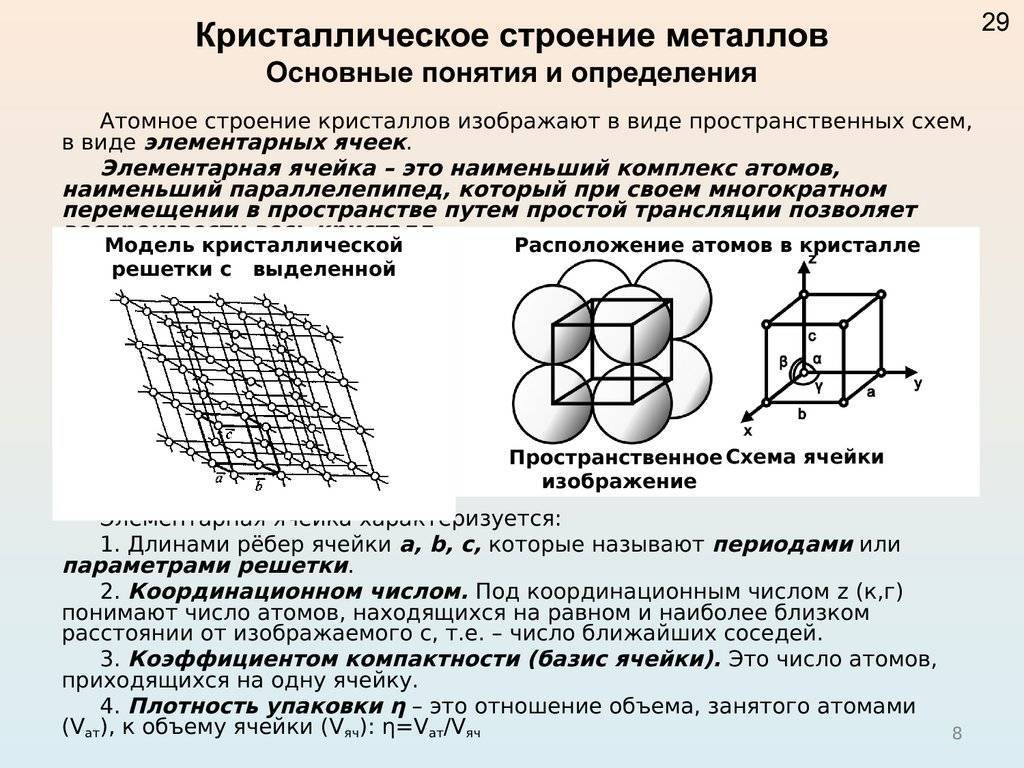
Кристаллической решеткой называют пространственный каркас, соединяющий точки пространства, в которых находятся частицы, образующие кристалл.
Точки пространства, в которых находятся образующие кристалл частицы, называют узлами кристаллической решетки.
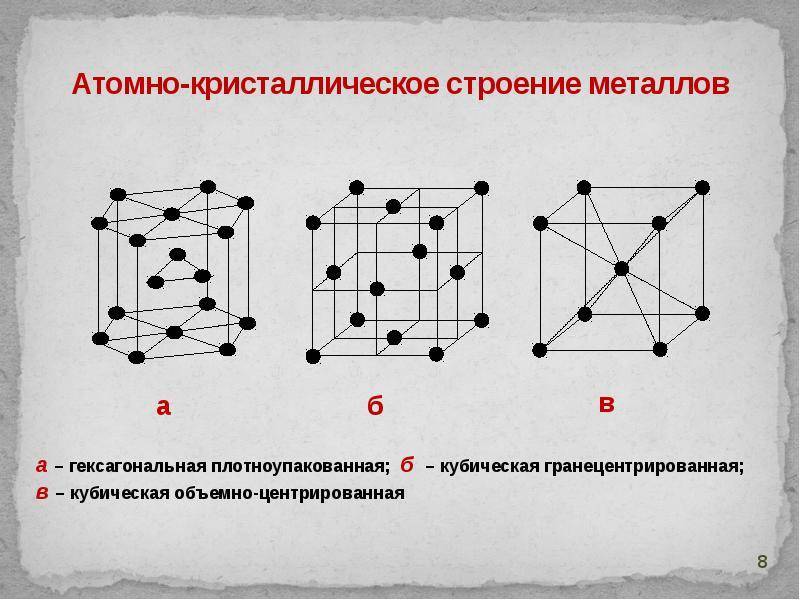
В зависимости от того, какие частицы находятся в узлах кристаллической решетки, различают: молекулярную, атомную, ионную и металлическую кристаллические решетки.
В узлах молекулярной кристаллической решетки Кристаллическая решетка льда Кристаллическая решетка льда как пример молекулярной решетки
находятся молекулы, внутри которых атомы связаны прочными ковалентными связями, однако сами молекулы удерживаются друг возле друга слабыми межмолекулярными силами. Вследствие таких слабых межмолекулярных взаимодействий кристаллы с молекулярной решеткой являются непрочными. Такие вещества от веществ с иными типами строения отличаются существенно более низкими температурами плавления и кипения, не проводят электрический ток, могут как растворяться, так и не растворяться в различных растворителях.
Растворы таких соединений могут как проводить, так и не проводить электрический ток в зависимости от класса соединения. К соединениям с молекулярной кристаллической решеткой относятся многие простые вещества — неметаллы (отвержденные H2, O2, Cl2, ромбическая сера S8, белый фосфор P4), а также многие сложные вещества – водородные соединения неметаллов, кислоты, оксиды неметаллов, большинство органических веществ. Следует отметить, что, если вещество находится в газообразном или жидком состоянии, говорить о молекулярной кристаллической решетке неуместно: корректнее использовать термин — молекулярный тип строения.
кристаллическая решетка алмаза Кристаллическая решетка алмаза как пример атомной решетки В узлах атомной кристаллической решетки
находятся атомы. При этом все узлы такой кристаллической решетки «сшиты» между собой посредством прочных ковалентных связей в единый кристалл. Фактически, такой кристалл является одной гигантской молекулой. Вследствие особенностей строения все вещества с атомной кристаллической решеткой являются твердыми, обладают высокими температурами плавления, химически мало активны, не растворимы ни в воде, ни в органических растворителях, а их расплавы не проводят электрический ток. Следует запомнить, что к веществам с атомным типом строения из простых веществ относятся бор B, углерод C (алмаз и графит), кремний Si, из сложных веществ — диоксид кремния SiO2 (кварц), карбид кремния SiC, нитрид бора BN.
У веществ с ионной кристаллической решеткой в узлах решетки находятся ионы, связанные друг с другом посредством ионных связей.
Поскольку ионные связи достаточно прочны, вещества с ионной решеткой обладают сравнительно высокой твердостью и тугоплавкостью. Чаще всего они растворимы в воде, а их растворы, как и расплавы проводят электрический ток. К веществам с ионным типом кристаллической решетки относятся соли металлов и аммония (NH4+), основания, оксиды металлов. Верным признаком ионного строения вещества является наличие в его составе одновременно атомов типичного металла и неметалла.
Кристаллическая решетка хлорида натрия
Кристаллическая решетка хлорида натрия как пример ионной решетки Однако следует отметить, что в веществах с ионным типом строения нередко можно обнаружить, помимо ионных, также ковалентные полярные связи. Это наблюдается в случае сложных ионов, т.е. состоящих из двух или более химических элементов (SO42-, NH4+, PO43- и т.д.). Внутри таких сложных ионов атомы связаны друг с другом ковалентными связями.
Металлическая кристаллическая решетка
наблюдается в кристаллах свободных металлов, например, натрия Na, железа Fe, магния Mg и т.д. В случае металлической кристаллической решетки, в ее узлах находятся катионы и атомы металлов, между которыми движутся электроны. При этом движущиеся электроны периодически присоединяются к катионам, таким образом нейтрализуя их заряд, а отдельные нейтральные атомы металлов взамен «отпускают» часть своих электронов, превращаясь, в свою очередь, в катионы. Фактически, «свободные» электроны принадлежат не отдельным атомам, а всему кристаллу.
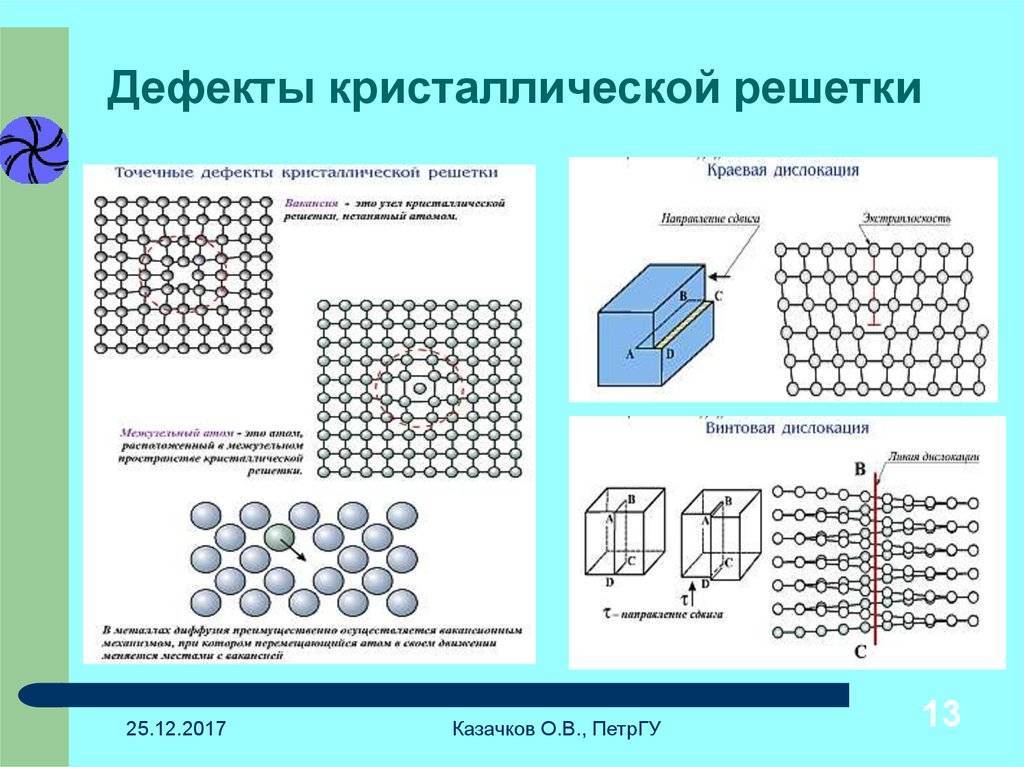
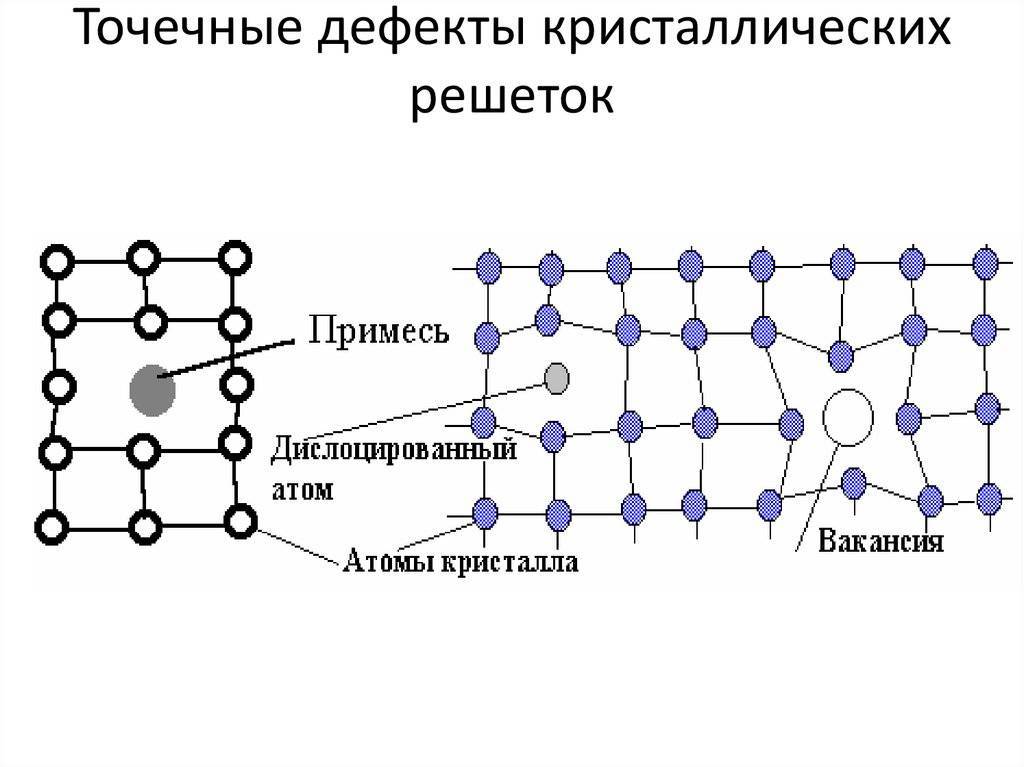
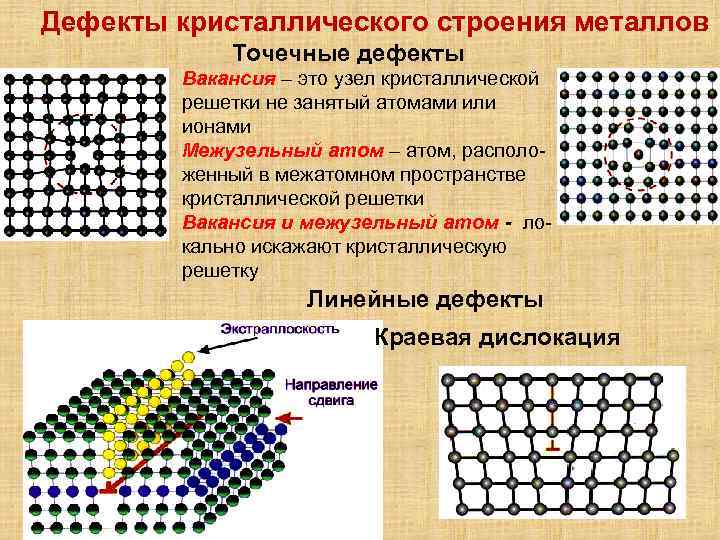
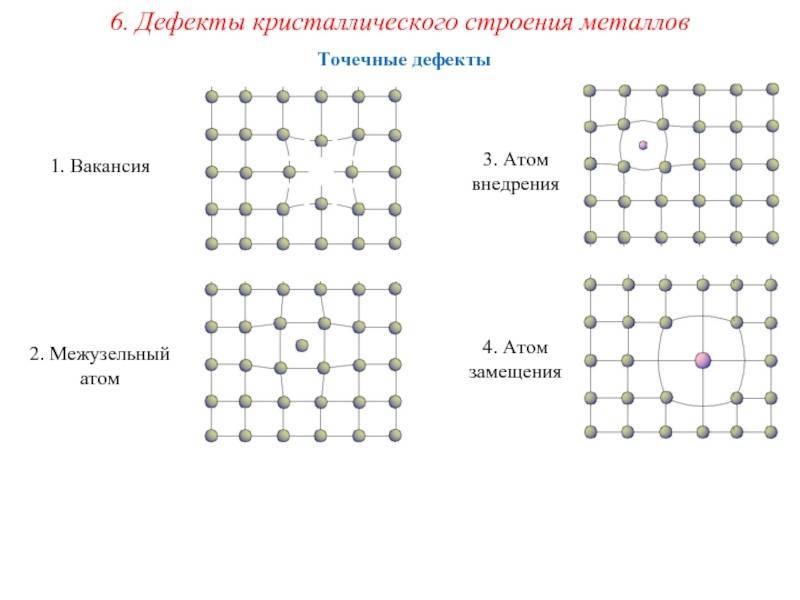
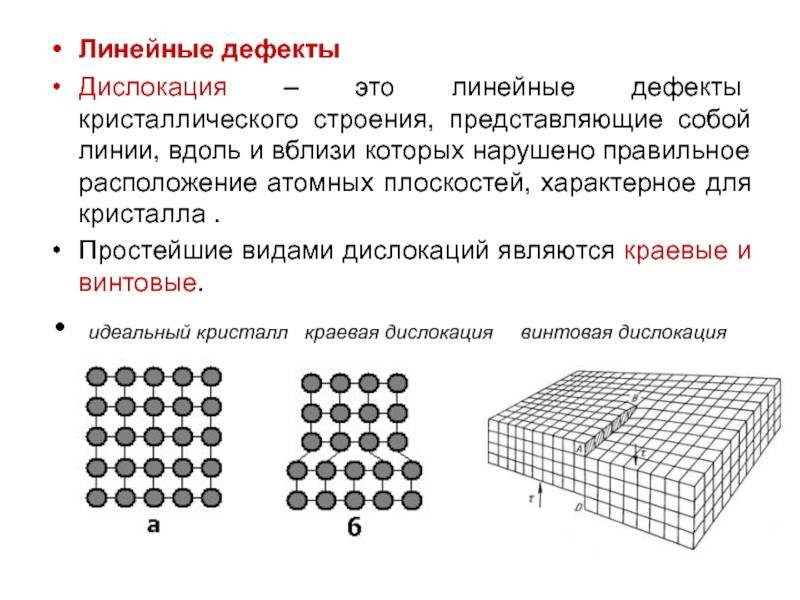
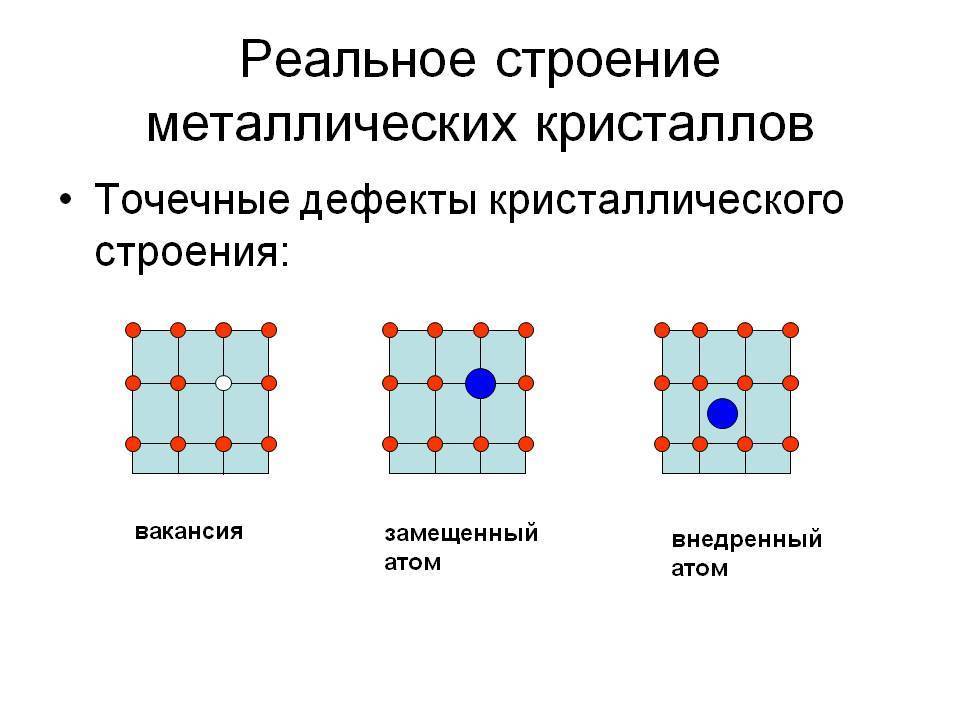
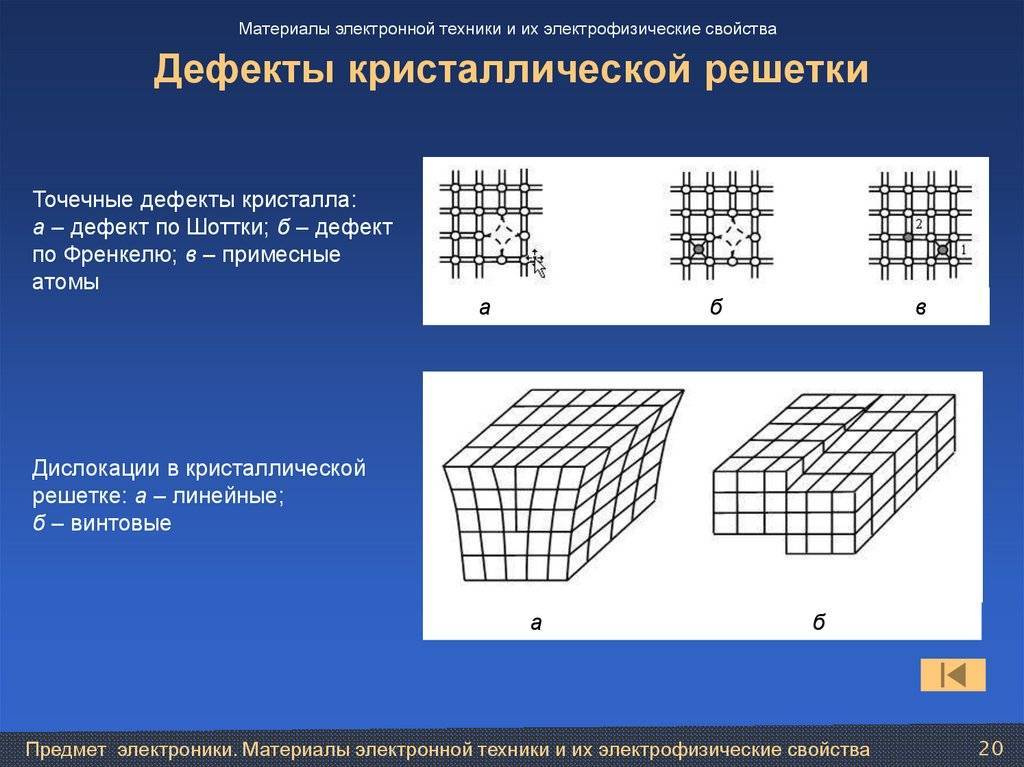
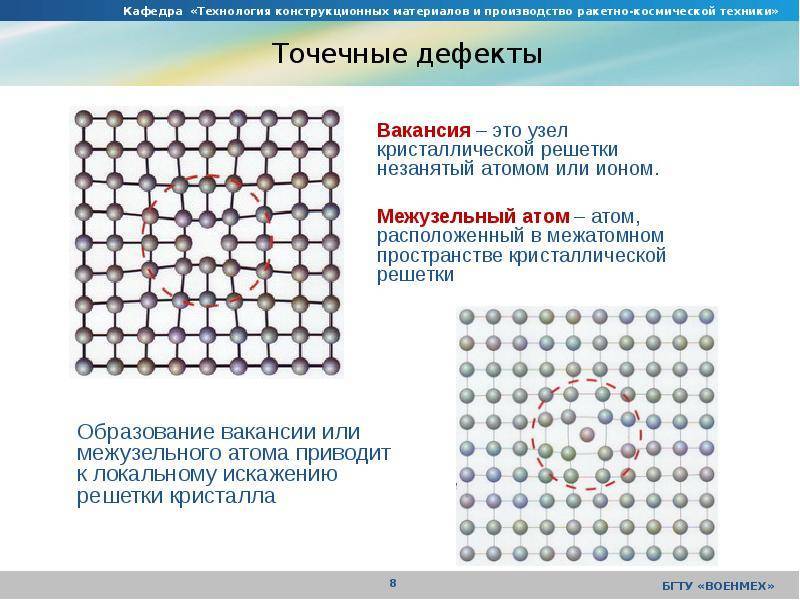
Реальный кристалл металла
Какой бы химический металлический элемент не рассматривался, в действительности он представляет собой твердое вещество, в котором маленькие монокристаллы (зерна) соединены друг с другом в различных ориентациях. Такая структура образует поликристалл. В нем, помимо границ зерен, присутствуют дефекты всех четырех типов, включая примеси таких неметаллов, как кислород, азот и водород. Последний из-за своих размеров легко проникает в любую кристаллическую решетку, образует с ее ионами твердые фазы, которые приводят к охрупчиванию металла, что является одной из актуальных проблем металловедения.
История появления меди
О том, какое великое значение имел этот химический элемент в истории человечества и планеты, можно догадаться уже по названиям исторических эпох. После каменного века наступил медный, а за ним — бронзовый, также имеющий прямое отношение к этому элементу.
Медь является одним из семи металлов, которые стали известны человечеству еще в древности. Если верить историческим данным, знакомство древних людей с этим металлом произошло примерно девять тысяч лет назад.
Древнейшие изделия из этого материала были обнаружены на территории современной Турции. Археологические раскопки, проведенные на месте крупного поселения времен неолита под названием Чаталхеюк, позволили отыскать небольшие медные шарики-бусины, а также медные пластины, которыми древние люди украшали свой наряд.
Найденные вещицы были датированы стыком восьмого и седьмого тысячелетий до нашей эры. Помимо самих изделий, на месте раскопок был обнаружен шлак, что говорит о производившихся выплавках металла из руды.
Получение меди из руды было относительно доступно. Поэтому несмотря на свою высокую температуру плавления, этот металл в числе первых был быстро и широко освоен человечеством.
Способы добычи
В природных условиях этот химический элемент существует в двух формах:
- соединения;
- самородки.
Любопытным фактом является следующее: медные самородки в природе попадаются гораздо более часто, чем золотые, серебряные и железные.
Природные соединения меди — это:
- оксиды;
- углекислые и сернистые комплексы;
- гидрокарбонаты;
- сульфидные руды.
Рудами, имеющими наибольшее распространение, являются медный блеск и медный колчедан. Меди в этих рудах содержится всего один-два процента. Первичная медь добывается двумя основными способами:
- гидрометаллургическим;
- пирометаллургическим.
Доля первого способа составляет десять процентов. Оставшиеся девяносто относятся ко второму методу.
Пирометаллический способ включает в себя комплекс процессов. Сначала медные руды обогащаются и обжигаются. Затем сырье плавится на штейн, после чего продувается в конвертере. Таким образом получается черновая медь. Превращение ее в чистую осуществляется путем рафинирования — сначала огневого, затем электролитического. Это последняя стадия. По ее окончании чистота полученного металла составляет практически сто процентов.
Процесс получения меди гидрометаллургическим способом делится на два этапа.
- Вначале сырье выщелачивается при помощи слабого раствора серной кислоты.
- На заключительном этапе металл выделяется непосредственно из упомянутого в первом пункте раствора.
Данный метод используется при переработке только бедных руд, так как, в отличие от предыдущего способа, при его проведении невозможно попутно извлечь драгоценные металлы. Именно поэтому приходящийся на этот способ процент так невелик по сравнению с другим методом.
Немного о названии
Химический элемент Cuprum, обозначаемый символом Cu, получил свое название в честь небезызвестного острова Кипр. Именно там в далеком третьем веке до нашей эры были обнаружены крупные месторождения медной руды. Местными мастерами, трудившимися на этих рудниках, производилась выплавка данного металла.
Свойства алмаза и графита
Коротко об аллотропном углероде и карбине. В периодической таблице Менделеева этот тип неметалла расположен под номером 6. Валентное состояние углерода коренным образом влияет на свойства вещества, в котором он присутствует.
Несмотря на то, что алмаз от графита отличается по всем характеристикам, оба минерала построены из свободного углерода.
Химические свойства
Структура кристалла алмаза пространственная. Алмаз и графит – это прочно связанные между собой тетраэдры, внутри которых атомы с ковалентной связью удалены друг от друга на равные расстояния. Доля углерода приближается к 99,8%. Незначительные примеси влияют на «чистоту» и оттенок самородка. Известно о химической стойкости к воздействию кислот и щелочей.
Важно помнить о том, что при высокой температуре сжигания от 800 до 1000 градусов на воздухе молекулы алмаза превращаются в кучку графита. Сущность кристаллической решетки графита состоит из слоев
Отдельные слои выглядят как связанные между собой шестиугольники, похожие на пчелиные соты. Расположение слоев относительно друг друга не структурированное и может различаться в самородках. Атомы связаны прочно только в пределах одного пласта. Соседние слои жестких связей между атомами не имеют. Содержат различные включения. Графит не растворяется в кислотах. При высокой температуре сгорает до аморфного газа, взаимодействуя с кислородом. Щелочные металлы и соли могут образовывать с ним «соединения включения»
Сущность кристаллической решетки графита состоит из слоев. Отдельные слои выглядят как связанные между собой шестиугольники, похожие на пчелиные соты. Расположение слоев относительно друг друга не структурированное и может различаться в самородках. Атомы связаны прочно только в пределах одного пласта. Соседние слои жестких связей между атомами не имеют. Содержат различные включения. Графит не растворяется в кислотах. При высокой температуре сгорает до аморфного газа, взаимодействуя с кислородом. Щелочные металлы и соли могут образовывать с ним «соединения включения».
Физические свойства
Различие в строении алмаза и графита обуславливает и разные физические свойства:
- Твердость. Алмаз – это самый твердый и плотный из созданных природой минералов. Он обладает минимальным коэффициентом сжатия. Графит имеет мягкую структуру, на ощупь жирный. Несмотря на разное значение плотности, оба они хрупкие и рассыпаются при падении или ударе.
- Прозрачность. Непрозрачный, серый или темно-серый графит поглощает свет. При трении отслаивается и оставляет темные следы на поверхности. Металлические включения дают самородку блеск. Строение кристаллов в алмазе дает прозрачность. Природные самоцветы не всегда абсолютно прозрачные и бесцветные. Некоторые имеют цветной оттенок. Мутные кристаллы ценятся ниже.
- Теплопроводность. Алмаз обладает самым высоким показателем, в сравнении с другими твердыми телами. Отличный полупроводник, способный работать при высоких температурах. У графита этот показатель теплопроводности крайне низкий.
- Электропроводность. Если замерять этот параметр вдоль слоев графита, результат окажется довольно высоким, приближенным к металлу. Поперек плоскостей он в сотни раз меньше, а самый высокий – у рекристаллизованного графита. Алмаз не проводит электричество, он – диэлектрик.