Области применения лантана
Несмотря на то что, металлы группы лантаноидов очень малочисленно в земной коре, их используют в промышленности достаточно широко.
Из материалов, содержащих лантан, изготовляют колесики чрезвычайно популярных и востребованных зажигалок.

Так, оксид лантана применяют для изготовления оптических стекол (так называемого лантанового стекла). Линзы, призмы, изготовленные с применением этого металла, используются в фото- и киноаппаратуре, в астрономической оптике.
Хромит лантана, который легирован магнием, стронцием или кальцием применяется в изготовлении надежных и высокотемпературных нагревателей, способных работать с температурой до 1780 градусов Цельсия в кислородной атмосфере. С возрастанием температуры сопротивление хромита лантана уменьшается. Коэффициент термического расширения химического элемента лантана достаточно низкий, вследствие этого электронагреватели отличаются значительной долговечностью.
Оксиды лантана используются в синтезировании сверхпроводников, которые предназначены для работы в условиях высоких температур.
Нашел свое применение химический элемент лантан в изготовлении специальных стекол, предназначенных для остекления помещений. Такие полотна, в структуру которых входят соединения лантана, имеют уникальные свойства, они способны снижать температуру в помещениях до 7 градусов.
Лантано-никелевые сплавы (гидриды) широко используются в качестве аккумуляторов водорода. Они представляют собой емкие и надежные хранилища. Для них открыта перспектива быть широко примененными в автомобилестроении, в качестве емкостей для хранения альтернативного топлива.
В электронике лантан используется в качестве проводника. Гексаборид лантана нашел свою применение в электронных микроскопах, это позволило значительно повысить разрешающую способность электронных микроскопных систем, повысить их ресурс.
В качестве еще одной перспективы применения химического элемента лантана современные исследователи видят его в качестве основной составляющей аккумуляторов нового типа с твердым электролитом. Эксперименты показывают, что такие источники обладают высокой удельной электроемкостью. У них длительный срок сохранения энергии без потерь. Отличаются прочностью и долговечностью. Вследствие чего они, возможно, в недалеком будущем составят серьезную конкуренцию другим аккумуляторам.
В медицине препараты, содержащие лантан, нашли применение при гиперфосфатемии. Их назначают в качестве лекарственного средства, который препятствует всасыванию фосфатов при приеме пищи.
Индивидуальные доказательства
- Вольфганг Либшер, Эккехард Флюк: Систематическая номенклатура неорганической химии . Springer-Verlag, Берлин 1999, ISBN 3-540-63097-X .
- Номенклатура неорганической химии, Рекомендации ИЮПАК 2005 .
- AM Mariano: Экономическая геология редкоземельных минералов . В: Б. Р. Липин, Г. А. Маккей (ред.): Обзоры по минералогии , том 21 – Геохимия и минералогия редкоземельных элементов (1989). Опубликовано Минералогическим обществом Америки, ISBN 0-939950-25-1 , стр. 309-337.
- Георг Штайнхаузер : Структурная химия – Прикосновение к пустоте. В кн . : Новости химии. 66, 2018, стр 118,. DOI : .
- А. Ф. Holleman , Е. Wiberg , Н. Wiberg : Учебник неорганической химии . 102-е издание. Вальтер де Грюйтер, Берлин 2007, ISBN 978-3-11-017770-1 , стр. 1937.
- ДТВ атлас по химии . 1981 , часть 1. С. 220.
- ↑
Нахождение в природе
С точки зрения нахождения в природе лантаноиды делятся на 2 группы: цериевую ( Ce, Pr, Nd, Pm, Sm, Eu) и иттриевую ( Gd, Tb, Dy, Ho, Er, Tm, Yb, Lu). Данный раздел основывается на том, что в одних минералах встречаются преимущественно церий и его “группа”, а в других – иттрий вместе с остальными элементами. К минералам цериевой группы относится монацит (Это, La, Nb ….) PO 4. Он образует россыпи монацитового песка, куда, кроме него, входит кварц, рутил, оксид тория. В монацитового песка содержатся все минералы цериевой группы. Элементы этой же группы содержатся в изоморфных фторокарбонатах (Это, La ….) FCO 3 (бастнезит), а также в собственном силикате Ce 2 Si 2 O 7 (церит). К минералам иттриевой группе относится ксенотим (Y, Eu, Gd, …) РО 4, в котором лантаноиды изоморфно замещают друг друга.
Второй по важности редкоземельный минерал – бастнезит – во многом похож на него. Бастнезит тоже тяжелый, тоже блестящий, тоже не постоянен по окраске (чаще всего ярко-желтый). Но химически с монацита его объединяет только большое содержание лантана и лантаноидов
Если монацит – фосфат, то бастнезит – фторокарбонат редких земель, его состав обычно записывают так: (La, Се) FCO 3. Но, как часто бывает, формула минерала не полностью отражает его состав. В данном случае она указывает лишь на главные компоненты: в бастнезити 36,9-40,5% оксида церия и почти столько же (в сумме) оксидов лантана, празеодима и неодима. Но обычно в нем есть и другие лантаноидов
Но химически с монацита его объединяет только большое содержание лантана и лантаноидов. Если монацит – фосфат, то бастнезит – фторокарбонат редких земель, его состав обычно записывают так: (La, Се) FCO 3. Но, как часто бывает, формула минерала не полностью отражает его состав. В данном случае она указывает лишь на главные компоненты: в бастнезити 36,9-40,5% оксида церия и почти столько же (в сумме) оксидов лантана, празеодима и неодима. Но обычно в нем есть и другие лантаноидов.
Есть даже селективный неодимовый минерал – ешинит. В этот минерал входят окислы кальция, тория, тантала, ниобия, иттрия, лантана и лантаноидов, из которых в нем больше церия и неодима.
Лантаноиды распространены в природе не одинаково. Наиболее труднодоступные лантаноиды – тербий, тулий, лютеций (все это лантаноиды с нечетными атомными номерами) – стоят дороже золота и платины.
Ресурсы лантанидов довольно значительны – суммарный массовое содержание лантанидов (вместе с лантаном) в земной коре 0,01%, что близко к содержанию меди. Наиболее распространенными являются La, Ce i Nd. Известно более 250 минералов, содержащих лантаниды. Из них собственных минералов лантанидов – 60-65 (содержание редких земель более 5-8%). Это главным образом фосфаты, лития или флуорокарбонаты, титанониобаты. Важнейшие минералы, содержащие лантаниды: монацит, ксенотим, бастнезит, гадолинит, ортит, лопарит, евксенит, фергусонит, самарскит. Лантаниды концентрируются в различных типах магматогенных, осадочных и метаморфогенных месторождений.
В Украину руды лантанидов не добываются. Потребности страны (ок. 100 т / год) покрывает импорт. Промышленные концентрации лантанидов обнаружены в юго-восточной и юго-западной частях Украинского щита.
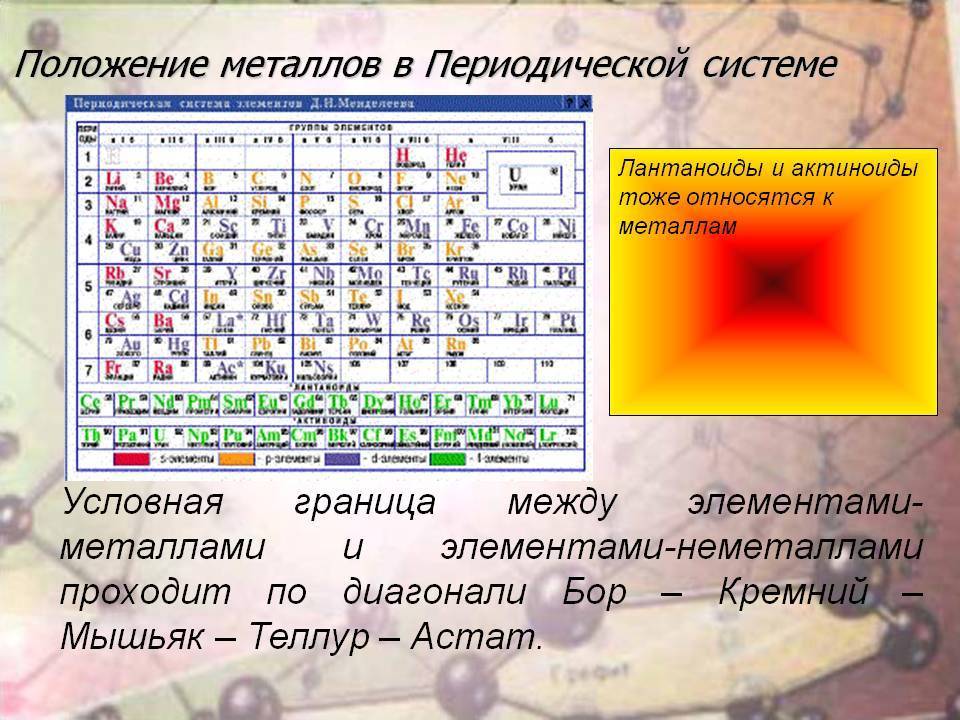
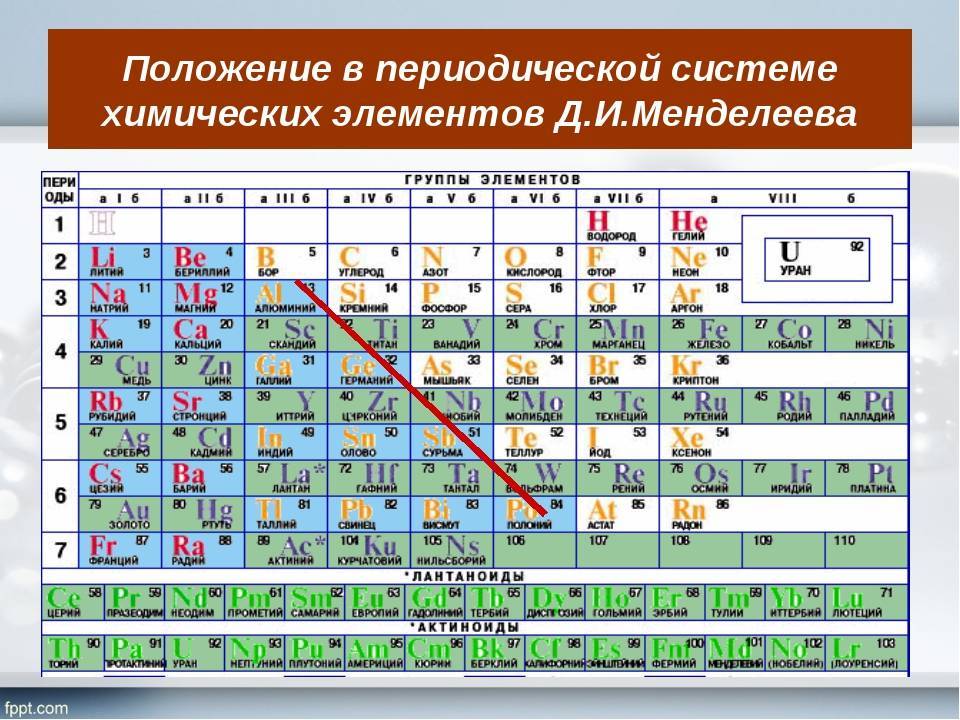
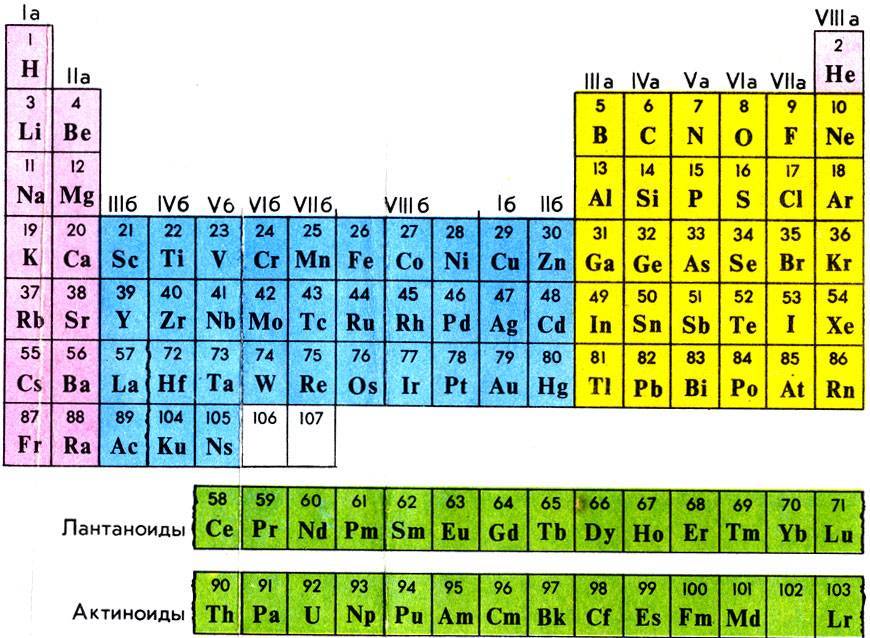
Как читать таблицу Дмитрия Ивановича Менделеева
Ячейки химической базы данных разбиты в группы последовательностей по горизонтали и вертикали. Элементы имеют краткое обозначение из 1-3 букв (для формул и вычислений).
Группы
Представлены в виде столбцов таблицы. В системе старого образца их 8.
В настоящий же момент выделено 18.
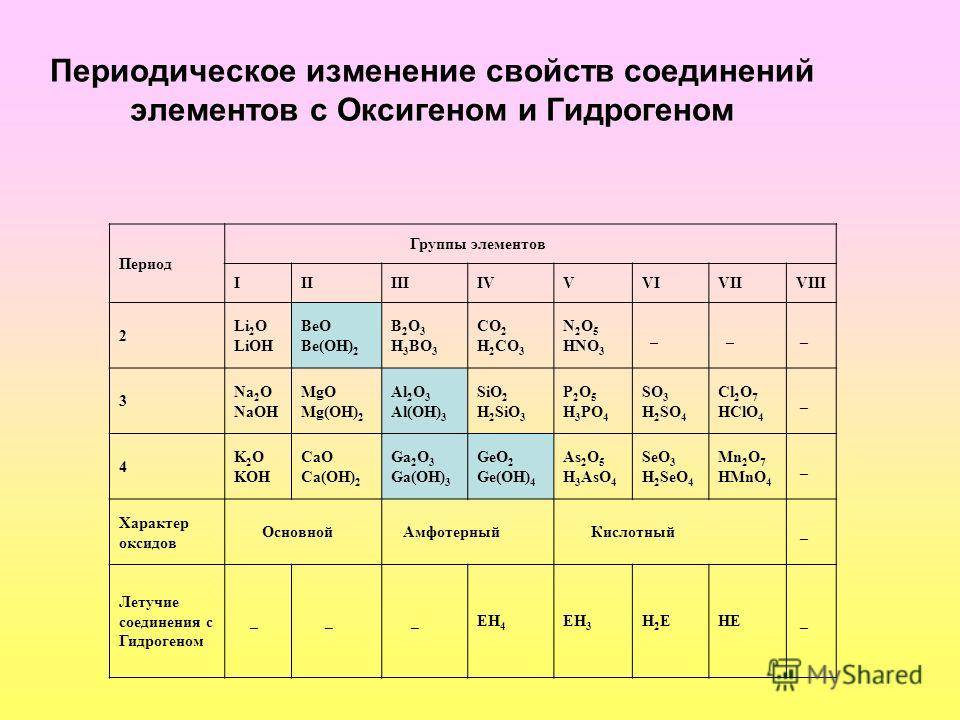
Распределяют элементы в группы по однотипности: по строению атома они подобны друг другу. Также у представителей одного столбца схожая формула высшего оксида.
Традиционные типы столбцов делятся на подкатегории: А (с яркими признаками группы) и В (переходные металлы). Принадлежность зависит от положения символа (слева для A или справа для B):
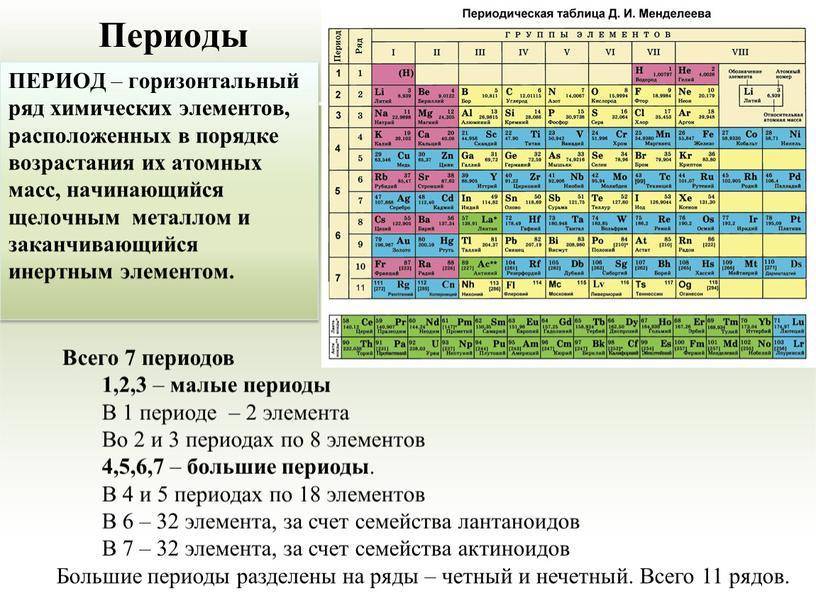
Периоды
Горизонтальные цепочки в таблице, в которых элементы расположены по росту порядкового номера. В линии слева направо увеличиваются заряды ядра атомов.
Периодов всего 7:
1-й период содержит лишь гелий He2 и водород H1;
2 и 3 содержат по 8 компонентов;
4-й и 5-й содержат 18 единиц каждый;
6-й период вмещает 32 элемента;
7-й хранит 31 единицу и продолжает дополняться.
Физический смысл порядкового номера
Порядковый номер химического элемента также показывает, сколько в составе ядра атома протонов и сколько электронов вращается вокруг него.
Меры предосторожности
| Опасности | |
|---|---|
| Пиктограммы GHS | |
| Опасность | |
| H260 | |
| P223, P231 + 232, P370 + 378, P422 | |
| NFPA 704 (огненный алмаз) |
Лантан имеет низкий или средний уровень токсичности, и с ним следует обращаться осторожно. Введение растворов лантана дает гипергликемия, низкое артериальное давление, дегенерация селезенка и печеночный переделки. Применение в свете угольной дуги привело к воздействию на людей оксидов и фторидов редкоземельных элементов, что иногда приводило к пневмокониоз
Как La3+ ион похож по размеру на Ca2+ ion, он иногда используется как легко обнаруживаемый заменитель последнего в медицинских исследованиях. Лантан, как и другие лантаноиды, влияет на метаболизм человека, снижая уровень холестерина, артериальное давление, аппетит и риск свертывания крови. При введении в мозг он действует как болеутоляющее, подобно морфий и другие опиаты, хотя механизм этого до сих пор неизвестен.
Лайфхак: как выучить таблицу химических элементов
Существует один весьма распространённый и устойчивый миф о том, что Дмитрий Менделеев открыл свою таблицу химических элементов во сне.
Друзья мои! Нужно быть совершенно недалёкого представления об учёных, чтобы утверждать о том, что научные открытия можно делать во сне или случайно. Известно высказывание самого Дмитрия Ивановича: «Я над ней (таблицей элементов — прим. Учёного Кота), может быть, двадцать лет думал, а вы думаете: сидел и вдруг… готово».
А пытались-то многие!
Попытки классифицировать и систематизировать химические элементы возникали задолго до Менделеева. Первую значимую попытку в 1829 году сделал немецкий химик Иоганн Вольфганг Дёберейнер, затем его труды развил другой немец — Леопольд Гмелин. Во Франции определённых успехов достиг химик-геолог Александр де Шанкуртуа. Однако все эти работы не выдерживали научной критики, как например, не смогла устоять система элементов, предложенная англичанином Джоном Ньюлендсом.
Лишь в 1869 году на заседании Русского химического комитета было заслушано сообщение Дмитрия Менделеева об открытии им фундаментального закона природы — Периодического закона. В том же году вышел его учебник «Основы химии», в котором впервые этот закон был представлен в виде таблицы.
Конечно же и труды Меделеева подверглись жесточайшей научной критике! Его идеи не сразу признавались научным сообществом. Лишь только после того, как были открыты новые химические элементы, предсказанные ранее Менделеевым, например, галлий, скандий, германий, Периодический закон был окончательно признан, как одна из теоретических основ химии.
Первый способ: «раскраска»
Так как легко и просто выучить периодическую таблицу химических элементов Менделеева?
Первым способом можно начать знакомство с периодической таблицей ещё в детстве. Подберите карандаши соответствующего цвета, наклейте наклеечки с названиями элементов и дайте ребёнку раскрашивать таблицу.
Второй способ: «Морской бой»
Второй способ более интересней. Многие наверняка знакомы с игрой «Морской бой». Распечатайте таблицу и обозначьте цифрами и буквами вертикали и горизонтали. «Морской бой» начинается!
Со временем можно усложнять игру — например, перестать нумеровать столбцы и строки. И играть, называя только названия:
- Селен!
- Ранил…
- Теллур!
- Ранил…
- Полоний!
- Убил.
Если идти по дальнейшему пути усложнения игры, то вместо названия химических элементов, можно называть его атомную или молекулярную массу.
Попробуйте! Вы будете лучше ориентироваться в таблице!
Применение лантаноидов
Эти металлы получили достаточно широкое применение. Они используются в качестве добавок при изготовлении различных марок стали, чугуна или других сплавов. Добавление лантаноидов позволяет повысить механическую стойкость, значительно улучшить показатели антикоррозийной устойчивости, улучшить показатели жаропрочности. Особое место они занимают в производстве специальных сортов стекла, которое применяется в атомной технике. В результате добавления лантаноидов в лаки и краски повышают уровень защиты поверхности от коррозии. При определённых составах они придают краскам люминесцирующие свойства. В радиоэлектронике эти металлы добавляют в материалы для изготовления катодов и при создании лазерной техники.
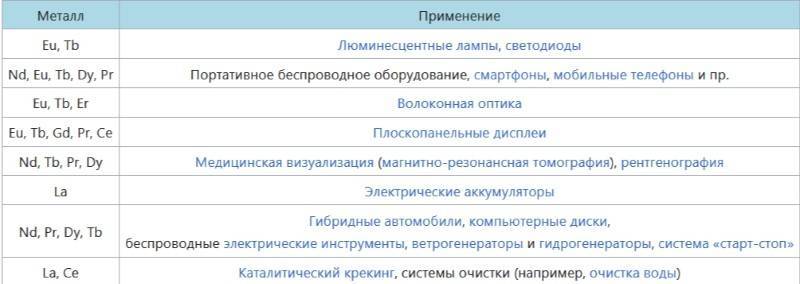
В перспективе планируется применять лантаноиды при создании так называемых оксибромидов, которые будут широко использоваться для проведения ранней диагностики онкологических заболеваний. При приёме этих препаратов кристаллы соединения с лантаноидами будут естественным образом подсвечивать место возникновения раковых клеток.
Использование свойства люминисцентности может быть использовано при создании альтернативных источников освещения, которые могут прийти на смену светодиодам. Разработанные на основе лантаноидов металлогели позволяют находить места появления дефектов в металле, выявление токсинов и патогенов.
Сокращение лантаноидов
→ Основная статья : Сокращение лантаноидов
Из-за сжатия лантаноидов атомный радиус почти непрерывно уменьшается в диапазоне от церия (183 мкм) до лютеция (172 мкм) (исключение составляют европий и иттербий). Это связано с тем, что элементы, которые – в зависимости от атомного номера – находятся перед лантаноидами, уже заполнили электронами оболочки 6s и 5p, но не оболочку 4f. Теперь лантаноиды заполняют 4f-оболочку электронами. В упрощенном представлении атома как состоящего из пространственно разделенных электронных оболочек, электронная оболочка, пространственно более близкая к ядру, теперь заполнена носителями заряда. Вдобавок ядро, конечно, заполнено тем же числом протонов, что и электроны, добавленные к 4f-оболочке. В результате более сильное притяжение между электронами и протонами сокращает атомный радиус, в то время как атомный номер увеличивается.
Этот эффект на самом деле не является исключительным, поскольку радиус всегда уменьшается, когда чаша наполняется в течение определенного периода времени. Однако это свойство имеет некоторые последствия:
- Благодаря уменьшающимся размерам легко возможно разделение с помощью ионообменников .
- В гольмии радиус Ln 3+ настолько мал, что почти соответствует радиусу Y 3+ ; поэтому иттрий обычно встречается вместе с «тяжелыми землями».
- Внутри группы переходные элементы во 2-й и 3-й позициях имеют очень похожие свойства.
Распространение в природе
Оксиды актиноидов и лантаноидов часто называют циркониевой, ториевой, иттриевой землями. Они являются основным источником для получения соответствующих металлов. Уран, как главный представитель актиноидов, находится в наружном слое литосферы в форме четырёх видов руд или минералов. Прежде всего, это урановая смолка, представляющая собой двуокись урана. В ней содержание металла самое высокое. Часто диоксиду урана сопутствуют радиевые месторождения (жилы). Они встречаются в Канаде, Франции, Заире. Комплексы ториевой и урановой руды часто содержат руды других ценных металлов, например золота или серебра.
Запасами такого сырья богаты Россия, Южно-Африканская республика, Канада и Австралия. В некоторых осадочных породах содержится минерал карнотит. В его состав, кроме урана, входит еще и ванадий. Четвертый вид уранового сырья – это фосфатные руды и железоурановые сланцы. Их запасы находятся в Марокко, Швеции и США. В настоящее время перспективными считаются также залежи лигнитов и каменного угля, содержащие примеси урана. Их добывают в Испании, Чехии, а также в двух американских штатах – Северной и Южной Дакоте.
– Источник
История
Карл Густав Мосандер, первооткрыватель лантана
В 1751 году шведский минералог Аксель Фредрик Кронштедт обнаружил тяжелый минерал из шахты на Bastnäs, позже названный церит. Тридцать лет спустя пятнадцатилетний Вильгельм Хисингерот семьи, владеющей шахтой, отправил образец Карл Шееле, который не нашел внутри никаких новых элементов. В 1803 году, после того как Хизингер стал мастером по производству железа, он вернулся к минералу с Йенс Якоб Берцелиус и выделили новый оксид, который они назвали церия после карликовая планета Церера, который был обнаружен двумя годами ранее. Церия была одновременно независимо изолирована в Германии Мартин Генрих Клапрот. Между 1839 и 1843 годами шведский хирург и химик показал, что церий представляет собой смесь оксидов. Карл Густав Мосандер, который жил в том же доме, что и Берцелиус: он выделил два других оксида, которые назвал лантана и дидимия. Он частично разложил образец нитрат церия запеканием на воздухе и последующей обработкой полученного оксида разбавленным азотная кислота. В том же году Аксель Эрдманн, студент Каролинского института, обнаружил лантан в новом минерале с острова Ловен, расположенного в норвежском фьорде.
Наконец, Мосандер объяснил свое промедление, сказав, что он извлек из церия второй элемент, который он назвал дидимием. Хотя он и не осознавал этого, дидим тоже был смесью, и в 1885 году его разделили на празеодим и неодим.
Поскольку свойства лантана мало отличались от свойств церия и присутствовали вместе с ним в его солях, он назвал его от Древнегреческий λανθάνειν (букв. скрывать). Относительно чистый металлический лантан был впервые выделен в 1923 году.
§ 10. Периодический закон в свете теории строения атома
*Положение в периодической системе d- и f-элементов
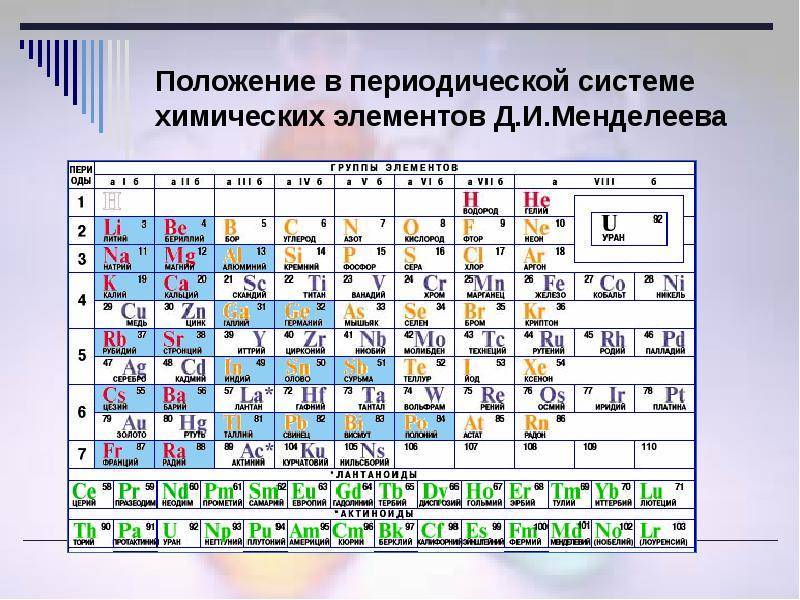
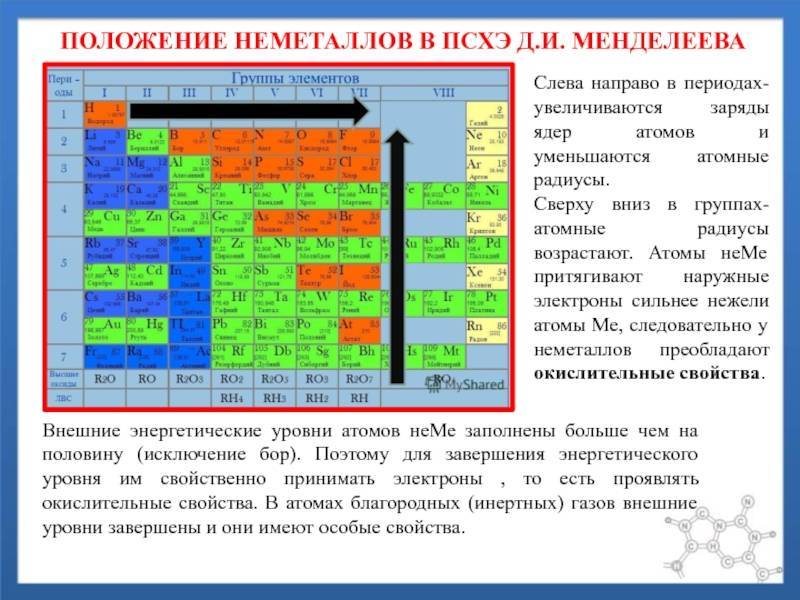
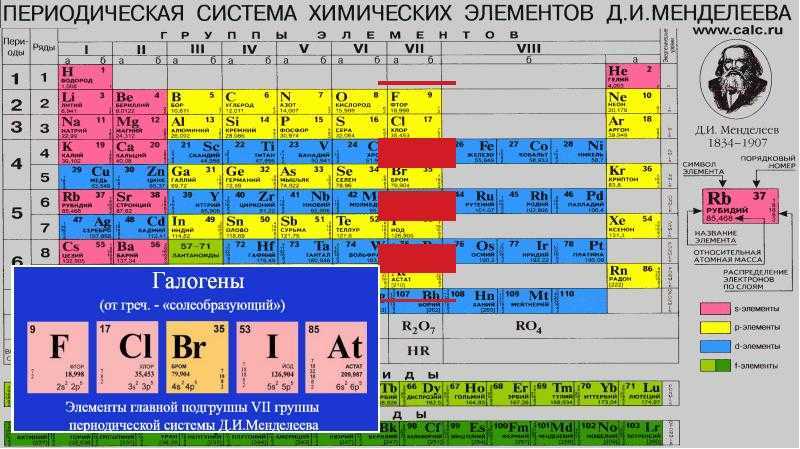
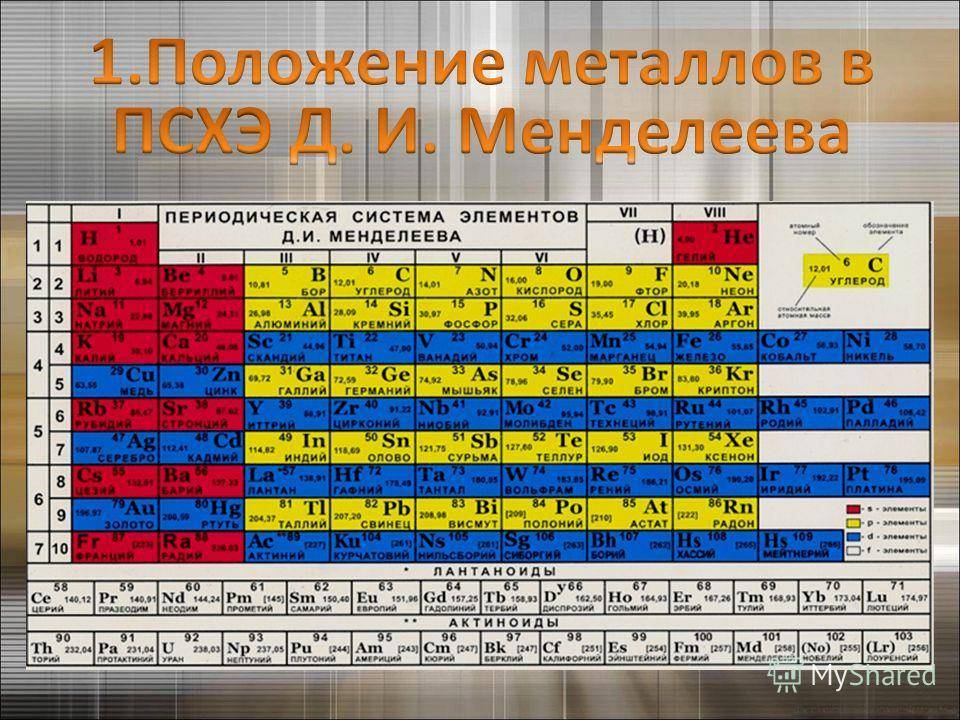
d– и f-Элементы относят к элементам B-групп. Так как эти элементы расположены в периодической системе между s– и p-элементами в 4–8-м периодах, их называют переходными.
В 4-м периоде (K — Kr) содержится 18 элементов. Ввиду большего числа элементов в этом периоде по сравнению с первыми тремя периодами Д. И. Менделеев назвал 4-й и последующие периоды большими.
Пятый период (Rb — Xe) построен аналогично 4-му: в нём также находится десять переходных d-элементов (Y — Cd).
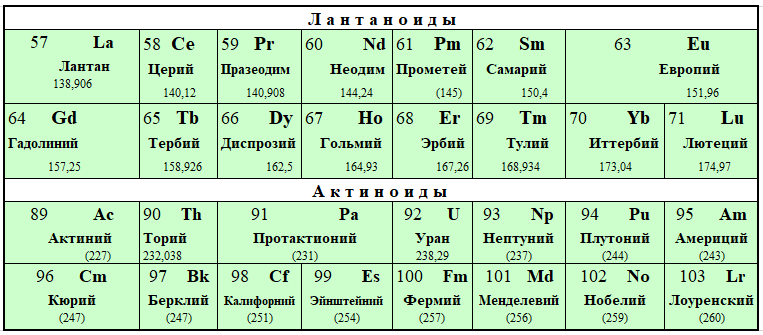
Шестой период (Cs — Rn) содержит 32 элемента. В него, помимо десяти d-элементов (Lu — Hg), включено 14 f-элементов. Элементы от лантана (La) до иттербия (Yb) в виде отдельного ряда вынесены вниз таблицы, который получил название «лантаноиды» по его первому элементу — лантану. Лантаноиды сходны по химическим свойствам. Это объясняется тем, что электронами у них заполняются внутренние 4f-орбитали, а валентный электронный слой имеет похожую электронную конфигурацию — чаще всего 5d16s2. В соединениях лантаноиды проявляют преимущественно степень окисления +3.
Седьмой период также содержит 32 элемента — от франция (Fr) до оганесона (Og). Период начинается с s-элементов (Fr и Ra), затем следуют 14 актиноидов (Ac — No). Эти элементы также вынесены в отдельный ряд внизу таблицы из-за близости их свойств, хотя они выражены меньше, чем у лантаноидов. Затем следуют десять 6d-элементов и шесть 6р-элементов. Все элементы этого периода являются радиоактивными, и большая их часть получена искусственным путём.
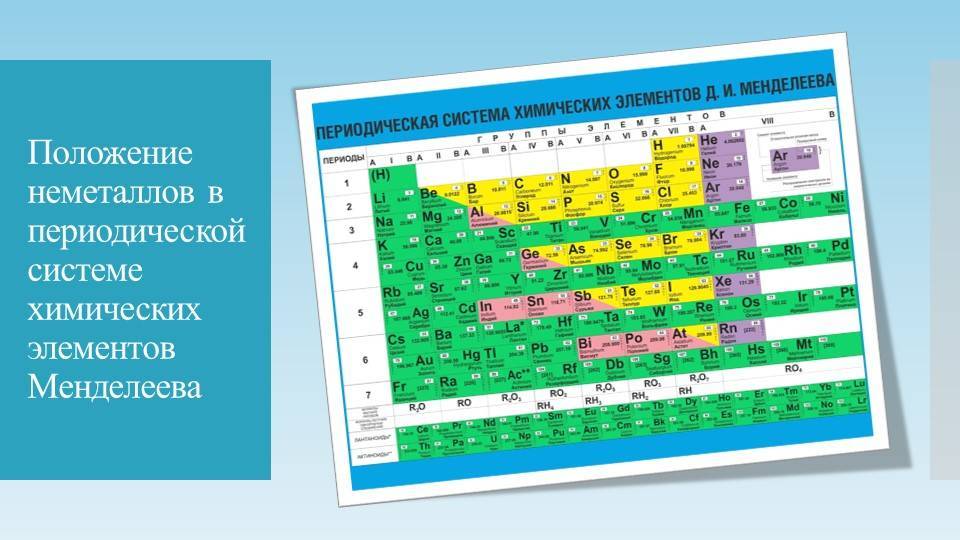
В периодической системе элементы разделены на группы. Две группы IA и IIA заполняют s-элементы. Далее располагаются десять В-групп, заполненных d-элементами. Завершают таблицу шесть А-групп, содержащих р-элементы.
Может ли быть открыто ещё больше химических элементов, чем известно сейчас? Ведь самые последние из известных элементов были открыты совсем недавно.
На этот вопрос отвечает теория ядерной физики. Пока с надёжностью предсказывают возможность существования химических элементов с порядковыми номерами до 126. В то же время есть научные концепции, которые предполагают искусственное получение химических элементов с порядковыми номерами до 173 с «островком стабильности» в области 164-го элемента.
У периодического закона нет привычного для физических законов математического выражения. Все попытки вывести математическую формулу периодического закона, предпринимавшиеся неоднократно, оказались безуспешными. В этом особенность свойств химических элементов и их соединений. Присущие им свойства не укладываются в простые математические выражения.
Своеобразной графической формой, выражающей периодический закон, стала периодическая система, которую Д. И. Менделеев представил в виде таблицы. По предложению ИЮПАК её так и называют: «Периодическая таблица элементов» (Periodic Table of the Elements), а у нас часто кратко: «Таблица Менделеева».
Таблица периодической системы — это иллюстрация закономерного расположения химических элементов относительно друг друга в периодической системе.
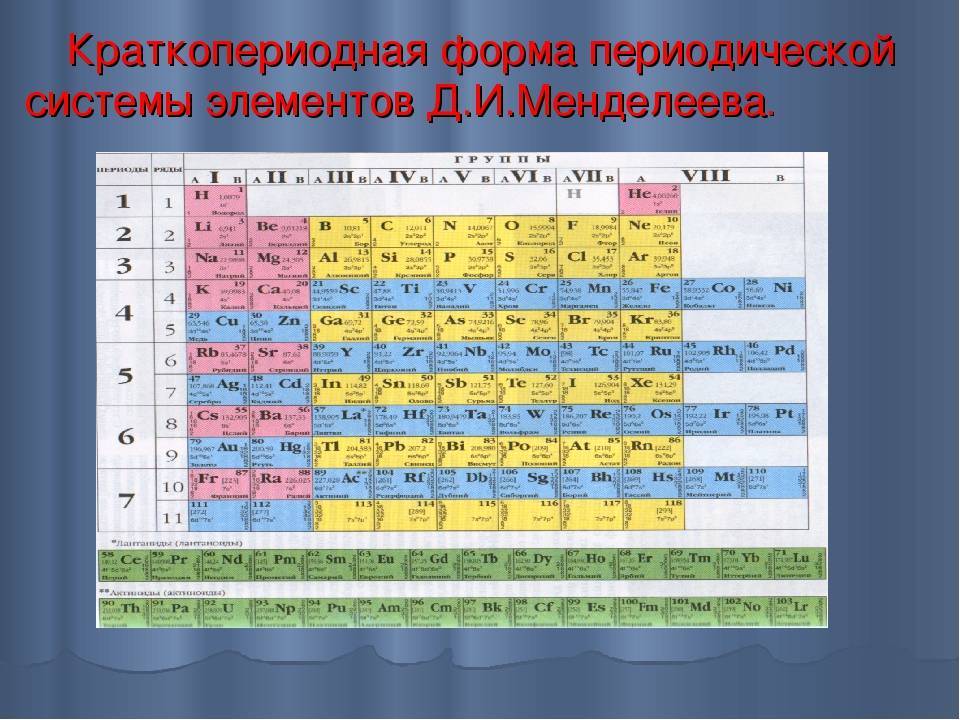
Менделеев посчитал более приемлемым представить периодическую систему в короткопериодной форме, которая в современном виде изображена на рисунке 20.1. В ней группы элементов подразделяются на подгруппы — главные и побочные. В главных подгруппах размещены s– и p-элементы, в побочных — d-элементы.
Рис. 20.1. Современный вариант короткопериодной периодической системы химических элементов
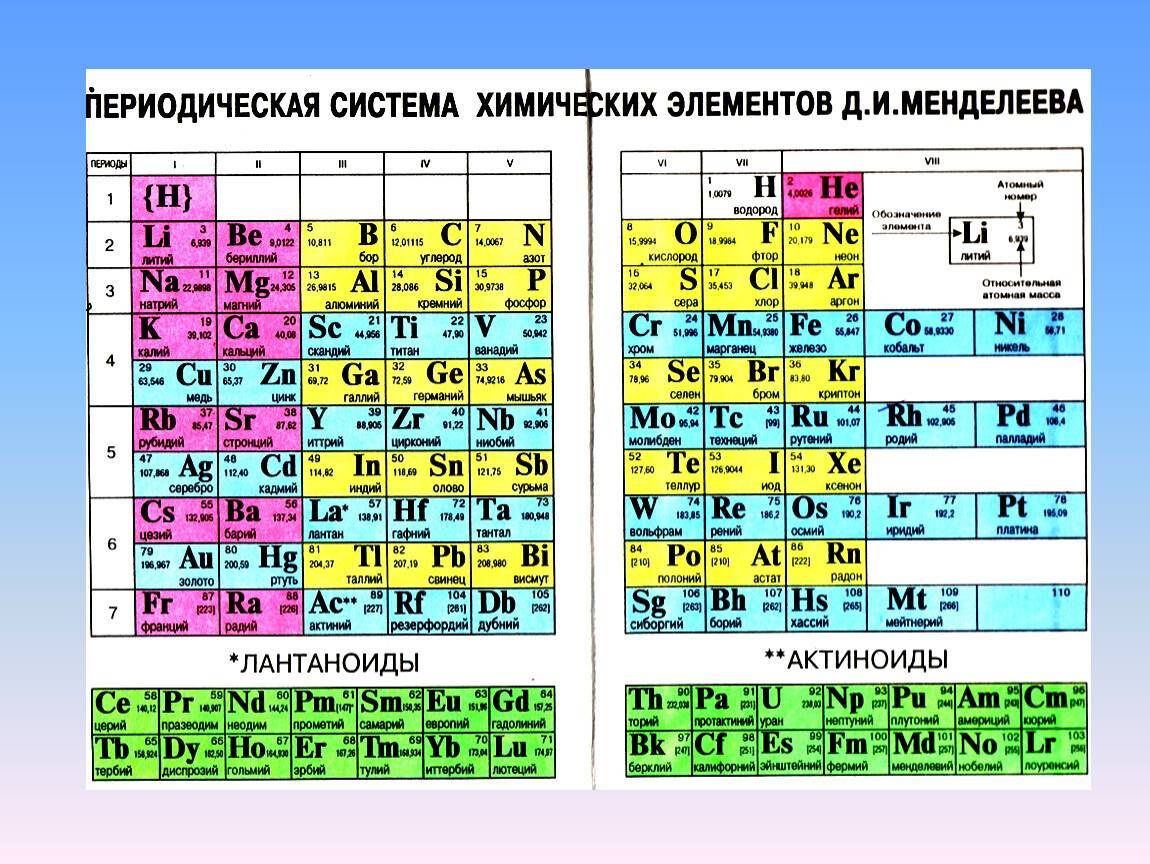
Позже ИЮПАК предложил использовать полудлиннопериодный вариант таблицы, в котором главные и побочные подгруппы были преобразованы в отдельные А- и В-группы: главные — в А-группы, побочные — в В-группы. Таких групп оказалось 18. Эта таблица изображена на форзаце учебника.
Существует вариант длиннопериодной таблицы, в которой f-элементы встроены в ряд с d-элементами (рис. 20.2). Существуют и другие варианты изображения периодической системы, их насчитывается около 500.
Рис. 20.2. Длиннопериодная форма периодической системы химических элементов
Общие свойства
Это блестящие металлы с серебристым блеском, которые быстро тускнеют на воздухе. По мере увеличения атомного номера они становятся все менее и менее мягкими . Их температура плавления и кипения выше, чем у большинства металлов, за исключением переходных металлов . Они бурно реагируют с большинством неметаллов и горят на воздухе. Это свойство используется в более легких камнях , которые сделаны из сплава лантаноидов, мишметалла .
Эти элементы не редкость в естественной среде, церий 58 Ce является 26- м или 27- м наиболее распространенным элементом земной коры (содержание того же порядка, что и у меди ). Неодима 60 Nd более многочисленно , чем кобальт , то лютеций 71 Л (менее обильные нерадиоактивные лантаноиды), однако, более обильный , чем серебро , и туллий более обильный , чем йод .
Лантаноиды довольно хорошо подтверждают эффект Оддо-Харкинса , согласно которому элементы с атомным номером больше 4 более распространены во Вселенной, когда их атомный номер четный, чем когда он нечетный.
Элемент Атомная масса Плавление температура Температура кипения массовый объем Атомный радиус Электронная конфигурация Энергия ионизации Электроотрицательность ( Полинг ) Ионный радиус трикации Ln 3+ Лантан 138,90547 ед. 920 ° С 3464 ° С 6,162 г · см -3 187 вечера 6s 2 5d 1 (*) 538,1 кДж · моль -1 1,10 103.2 вечера Церий 140,116 (1) ед. 795 ° С 3443 ° С 6,770 г · см -3 181,8 вечера 6s 2 4f 1 5d 1 (*) 534,4 кДж · моль -1 1,12 102 вечера Празеодим 140.90766 u 935 ° С 3 130 ° С 6,77 г · см -3 182 вечера 6s 2 4f 3 527 кДж · моль -1 1.13 99 вечера Неодим 144 242 (3) u 1,024 ° С 3074 ° С 7,01 г · см -3 181 вечера 6s 2 4f 4 533,1 кДж · моль -1 1.14 98.3 вечера Прометий 1042 ° С 3000 ° С 7,26 г · см -3 183 вечера 6s 2 4f 5 540 кДж · моль -1 1.13 97 вечера Самарий 150,36 (2) ед. 1072 ° С 1900 ° С 7,52 г · см -3 180 вечера 6s 2 4f 6 544,5 кДж · моль -1 1.17 95,8 вечера Европий 151 964 (1) ед. 826 ° С 1529 ° С 5,264 г · см -3 180 вечера 6s 2 4f 7 547,1 кДж · моль -1 1.2 94.7 вечера Гадолиний 157,25 (3) ед. 1312 ° С 3000 ° С 7,90 г · см -3 180 вечера 6s 2 4f 7 5d 1 (*) 593,4 кДж · моль -1 1,20 93.8 вечера Тербий 158.92 535 ед. 1,356 ° С 3,123 ° С 8,23 г · см -3 177 вечера 6s 2 4f 9 565,8 кДж · моль -1 1.2 92.3 вечера Диспрозий 162 500 (1) ед. 1,407 ° С 2,562 ° С 8,540 г · см -3 178 вечера 6s 2 4f 10 573,0 кДж · моль -1 1,22 91.2 вечера Гольмий 164.93033 ед. 1461 ° С 2600 ° С 8,79 г · см -3 176 вечера 6s 2 4f 11 581,0 кДж · моль -1 1,23 90,1 вечера Эрбий 167 259 (3) u 1529 ° С 2868 ° С 9,066 г · см -3 176 вечера 6s 2 4f 12 589,3 кДж · моль -1 1,24 89 вечера Тулий 168.93422 ед. 1545 ° С 1,950 ° С 9,32 г · см -3 176 вечера 6s 2 4f 13 596,7 кДж · моль -1 1,25 88 вечера Иттербий 173 045 ед. 824 ° С 1,196 ° С 6,90 г · см -3 176 вечера 6s 2 4f 14 603,4 кДж · моль -1 1.1 86,8 вечера Лютеций 174.9668 ед. 1,652 ° С 3,402 ° С 9,841 г · см -3 174 вечера 6s 2 4f 14 5d 1 523,5 кДж · моль -1 1,27 86,1 вечера
- (*) Исключения из правила Клечковского : лантан 57 La, церий 58 Ce, гадолиний 64 Gd.