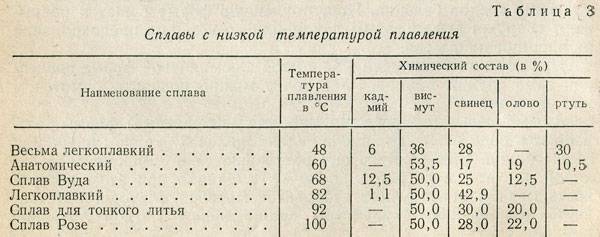
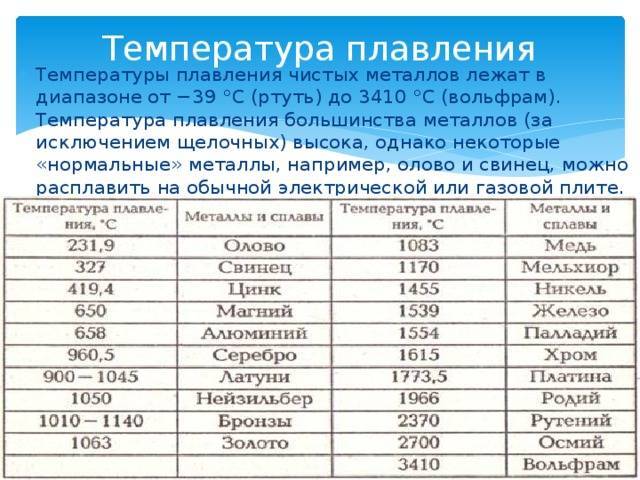
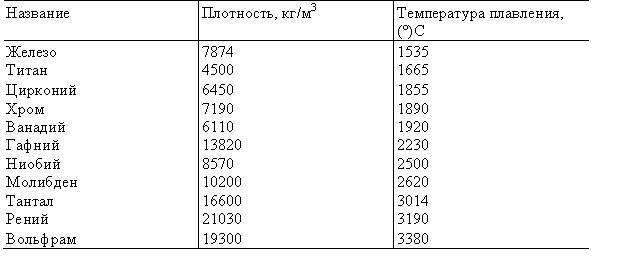
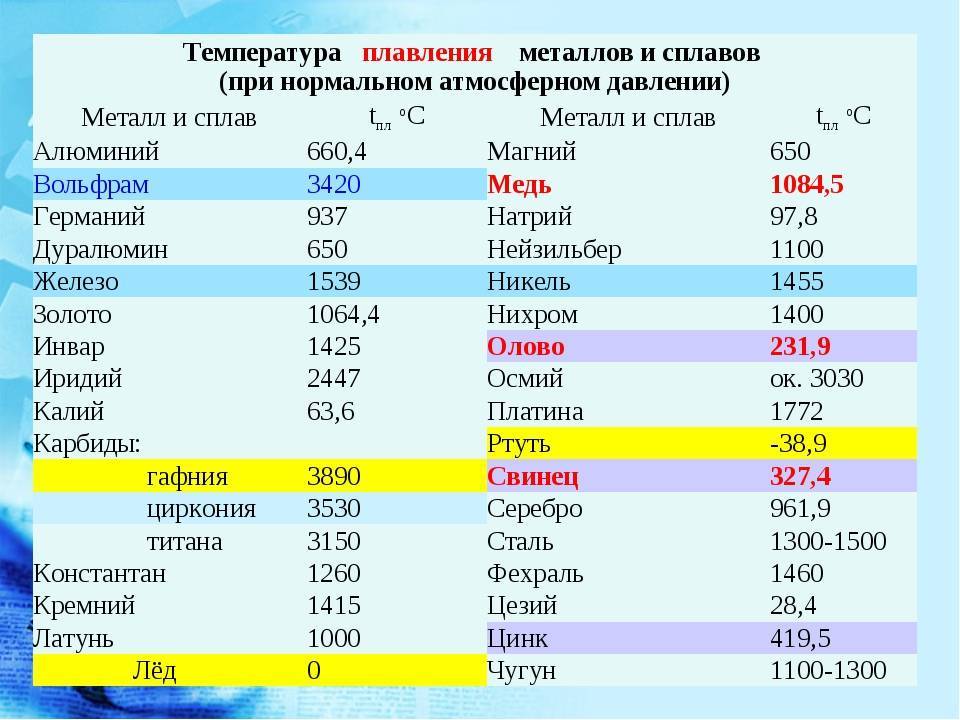
Таблица характеристик
Металлы и сплавы — непременная основа для ковки, литейного производства, ювелирной продукции и многих других сфер производства. Чтобы не делал мастер (ювелирные украшения из золота, ограды из чугуна, ножи из стали или браслеты из меди), для правильной работы ему необходимо знать температуры, при которых плавится тот или иной элемент.
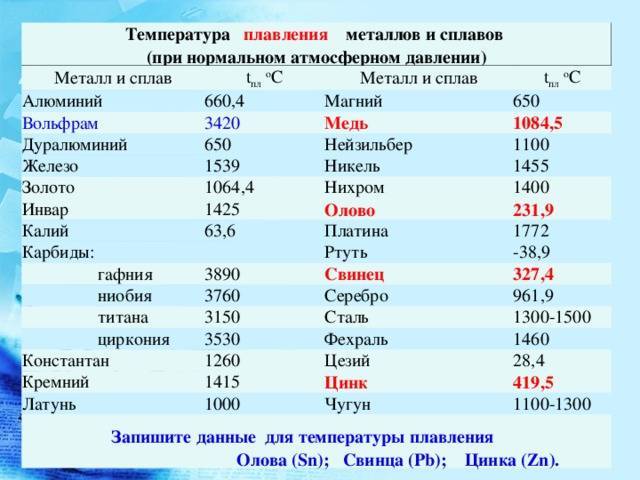
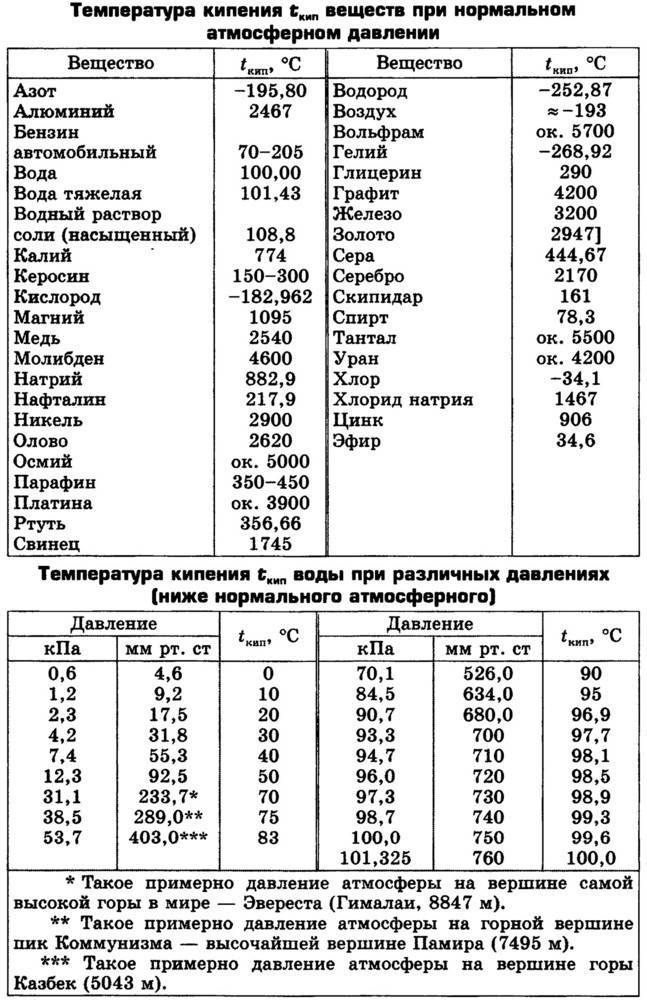
Чтобы узнать этот параметр, нужно обратиться к таблице. В таблице также можно найти и градус кипения.
Среди наиболее часто применяемых в быту элементов показатели температуры плавления такие:
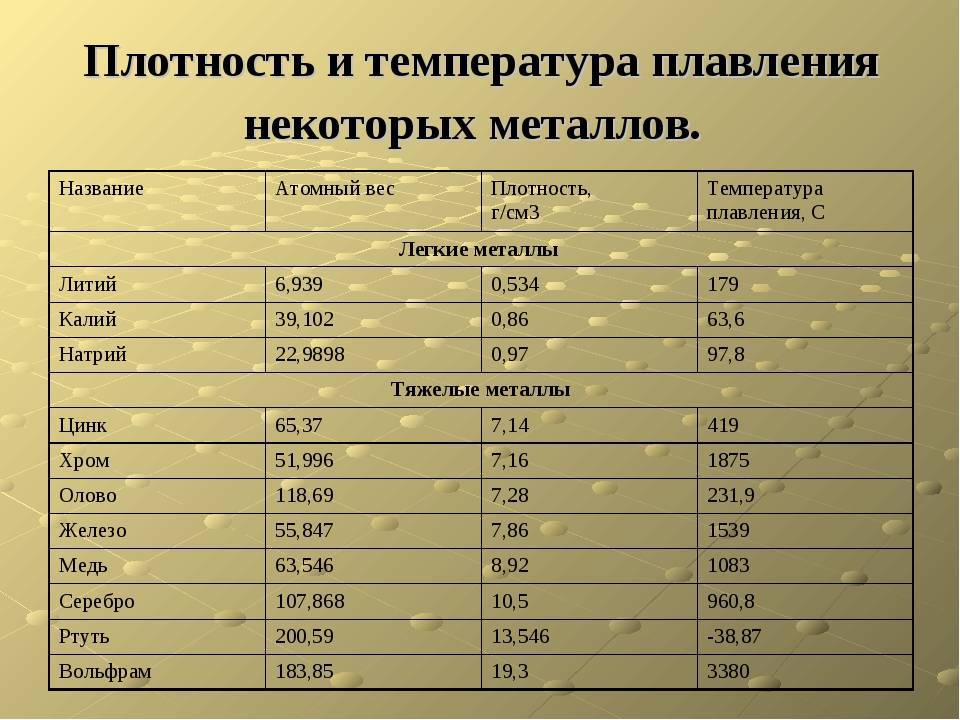
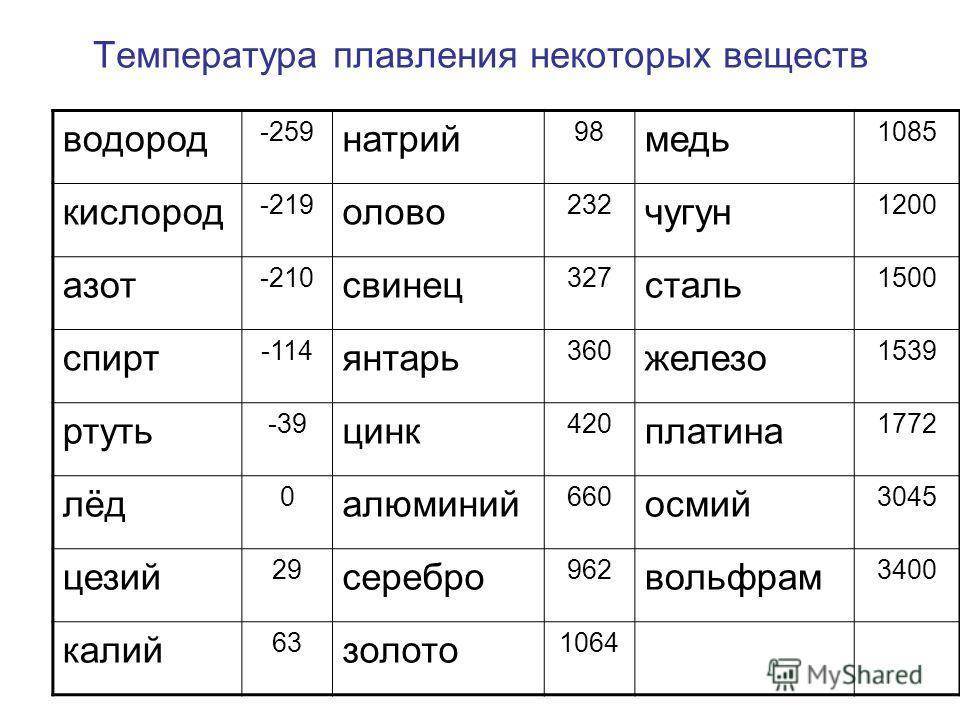
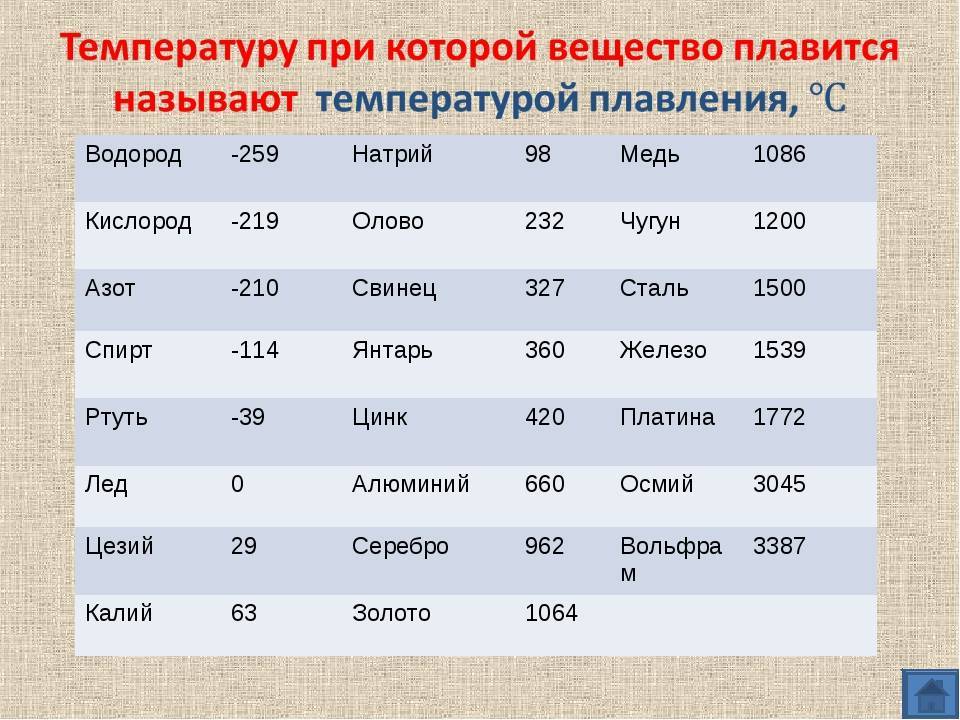
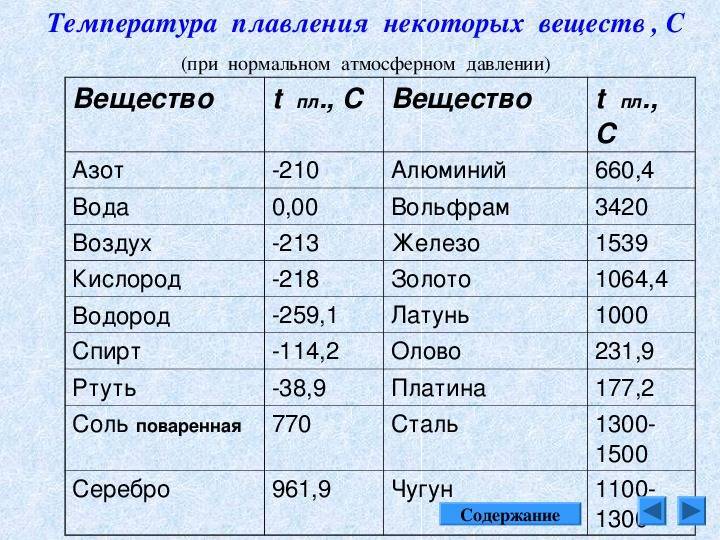
- алюминий — 660 °C;
- температура плавления меди — 1083 °C;
- температура плавления золота — 1063 °C;
- серебро — 960 °C;
- олово — 232 °C. Олово часто используют при пайке, так как температура работающего паяльника составляет как раз 250–400 градусов;
- свинец — 327 °C;
- температура плавления железо — 1539 °C;
- температура плавления стали (сплав железа и углерода) — от 1300 °C до 1500 °C. Она колеблется в зависимости от насыщенности стали компонентами;
- температура плавления чугуна (также сплав железа и углерода) — от 1100 °C до 1300 °C;
- ртуть — -38,9 °C.
Как понятно из этой части таблицы, самый легкоплавкий металл — ртуть, которая при плюсовых температурах уже находится в жидком состоянии.
Градус кипения всех этих элементов почти вдвое, а иногда и ещё выше градуса плавления. Например, у золота он 2660 °C, у алюминия — 2519 °C, у железа — 2900 °C, у меди — 2580 °C, у ртути — 356,73 °C.
У сплавов типа стали, чугуна и прочих металлов расчёт примерно такой же и зависит от соотношения компонентов в сплаве.
Читать также: Ремонт цепей для бензопил своими руками
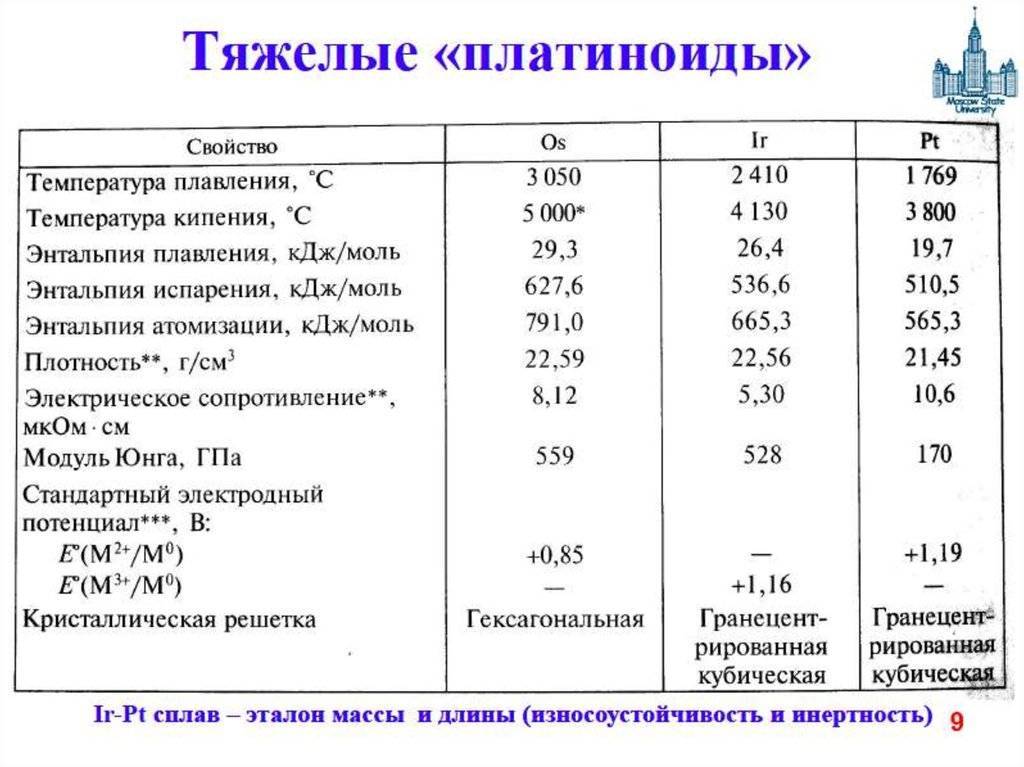
Максимальная температура кипения у металлов — у рения — 5596 °C. Наибольшая температура кипения — у наиболее тугоплавящихся материалов.
Бывают таблицы, в которых также указана плотность металлов. Самым лёгким металлом является литий, самым тяжёлым — осмий. У осмия плотность выше, чем у урана и плутония, если рассматривать её при комнатной температуре. К лёгким металлам относятся: магний, алюминий, титан. К тяжёлым относится большинство распространённых металлов: железо, медь, цинк, олово и многие другие. Последняя группа — очень тяжёлые металлы, к ним относятся: вольфрам, золото, свинец и другие.
Ещё один показатель, встречающийся в таблицах — это теплопроводность металлов. Хуже всего тепло проводит нептуний, а лучший по теплопроводности металл — серебро. Золото, сталь, железо, чугун и прочие элементы находится посередине между этими двумя крайностями. Чёткие характеристики для каждого можно найти в нужной таблице.
Каждый металл или сплав обладает уникальными свойствами, в число которых входит температура плавления. При этом объект переходит из одного состояния в другое, в конкретном случае становится из твёрдого жидким. Чтобы его расплавить, необходимо подвести к нему тепло и нагревать до достижения нужной температуры. В момент, когда достигается нужная точка температуры данного сплава, он ещё может остаться в твёрдом состоянии. При продолжении воздействия начинает плавиться.
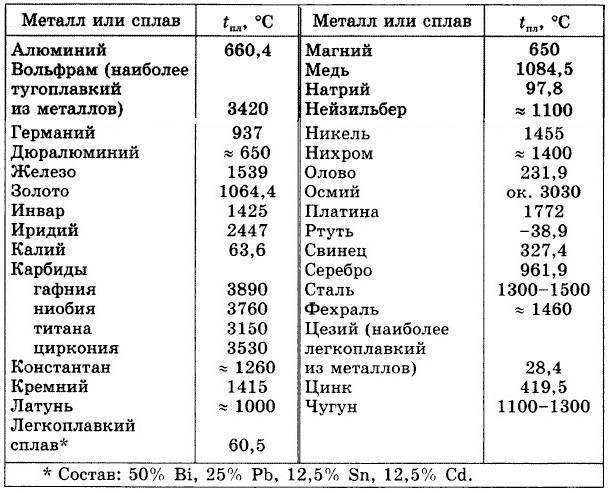
Наиболее низкая температура плавления у ртути – она плавится даже при -39 °C, самая высокая у вольфрама – 3422 °C. Для сплавов (стали и других) определить точную цифру крайне сложно. Все зависит от соотношения компонентов в них. У сплавов она записывается как числовой промежуток.
Самый тугоплавкий металл в мире — свойства, получение, применение
Определение «тугоплавкие металлы» не требует дополнительных пояснений в силу исчерпывающей информативности самого термина. Единственным нюансом остается пороговая температура плавления, после которой вещество можно считать тугоплавким.
Где применяется вольфрам?
Широко используют соединения вольфрама. Их применяют в машиностроительной и горнодобывающей промышленностях, для бурения скважин. Из данного металла благодаря его высокой прочности и твердости изготавливают детали двигателей летательных аппаратов, нити накаливания, артиллерийские снаряды, сверхскоростные роторы гироскопов, пули и т.д. Также вольфрам успешно применяется как электрод при аргонно-дуговой сварке. Не обходятся и такие отрасли промышленности без соединений вольфрама – текстильная, лакокрасочная.
Определение
Большинство определений термина тугоплавкие металлы
определяют их как металлы имеющие высокие температуры плавления. По этому определению, необходимо, чтобы металлы имели температуру плавления выше 4,000°F (2,200°C ). Это необходимо для их определения как тугоплавких металлов.
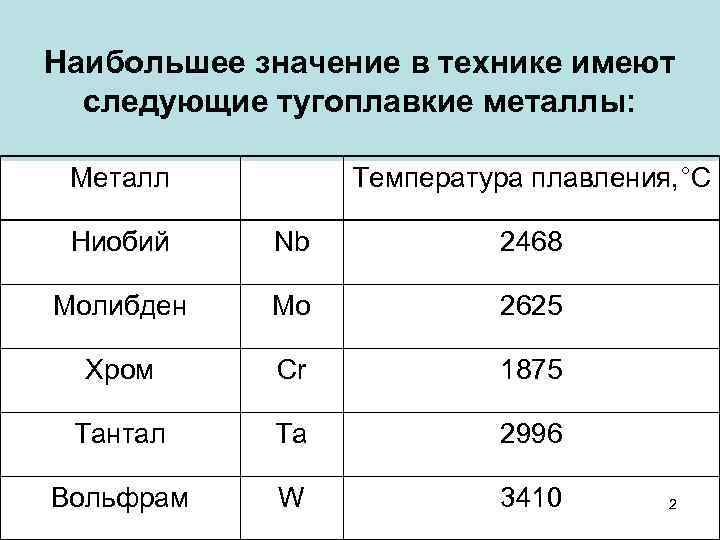
Пять элементов — ниобий, молибден, тантал, вольфрам и рений входят в этот список как основные, в то время как более широкое определение этих металлов позволяет включить в этот список ещё и элементы имеющие температуру плавления 2123 K (1850 °C) — титан, ванадий, хром, цирконий, гафний, рутений и осмий.
Трансурановые элементы (которые находятся за ураном, все изотопы которых нестабильны и на земле их найти очень трудно) никогда не будут относиться к тугоплавким металлам.
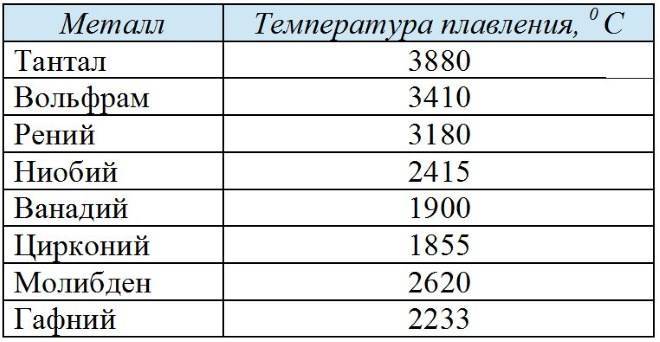
Сравнительная таблица степени тугоплавкости чистых металлов
Следует отметить, что тугоплавкие материалы не ограничиваются исключительно металлами. К этой категории относится ряд соединений – сплавы и легированные металлы, разработанных, чтобы улучшить определенные характеристики исходного материала.
Относительно чистых элементов, можно привести наглядную таблицу степени их температурной устойчивости. Возглавляет ее самый тугоплавкий металл, известный на сегодня, – вольфрам с температурой плавления 3422 0С. Такая осторожная формулировка связана с попытками выделить металлы, обладающие порогом расплава, превосходящим вольфрам.
Поэтому вопрос, какой металл самый тугоплавкий, может в будущем получить совсем иное определение.
Пороговые величины остальных соединений приведены ниже:
- рений 3186;
- осмий 3027;
- тантал 3014;
- молибден 2623;
- ниобий 2477;
- иридий 2446;
- рутений 2334;
- гафний 2233;
- родий 1964;
- ванадий 1910;
- хром 1907;
- цирконий 1855;
- титан 1668.
Остается добавить еще один интересный факт, касающийся физических свойств жапропрочных элементов. Температура плавления некоторых из них чувствительная к чистоте материала. Ярким примером этому выступает хром, температура плавления которого может варьироваться от 1513 до 1920 0С, в зависимости от химического состава примесей. Поэтому, данные интернет пространства часто разнятся точными цифрами, однако качественная составляющая от этого не страдает.
Хром в чистом виде
Свойства самых тугоплавких металлов
Так самый тугоплавкий металл в мире (вольфрам) обычно легируется рением, торием, никелем при участии меди и/или железа. Первый делает сплав более коррозионстойким, второй — более надежным, а третий — придает небывалую плотность
Следует обратить внимание, что во всех сплавах вольфрама содержится не более 4/5
Из-за того, что вольфрам одновременно и твердый, и тугоплавкий его обычно применяют в электроснабжении, строении приборов, изготовлении оружия, снарядов, боеголовок и ракет. Более плотные сплавы (на базе никеля) применяют для производства клюшек для игры в гольф. Вольфрам образует и так называемые псевдосплавы. Дело в том, что в них металл не легируется, а наполняется жидким серебром или медью.
За счет разницы в температурах расплава получаются лучшие тепло и электропроводные свойства.
Это дает возможность использовать его для изготовления форм для литья цинковых деталей. Особое направления использования молибдена — в качестве легирующего элемента в стальных сплавах. Сплавы сталь+молибден обладают хорошей износостойкостью и невысокими показателями трения.
Сталь+молибден применяют в для изготовления труб, трубных конструкций, автомобиле и машиностроении.
Сферы применения
Тантал – важный материал для разработки высоких технологий. Сегодня металл используют в электронике для создания конденсаторов. Их можно сделать очень маленькими, что удобно для производства гаджетов. Поэтому танталовые конденсаторы присутствуют практически в любых смартфонах, ноутбуках и планшетах.
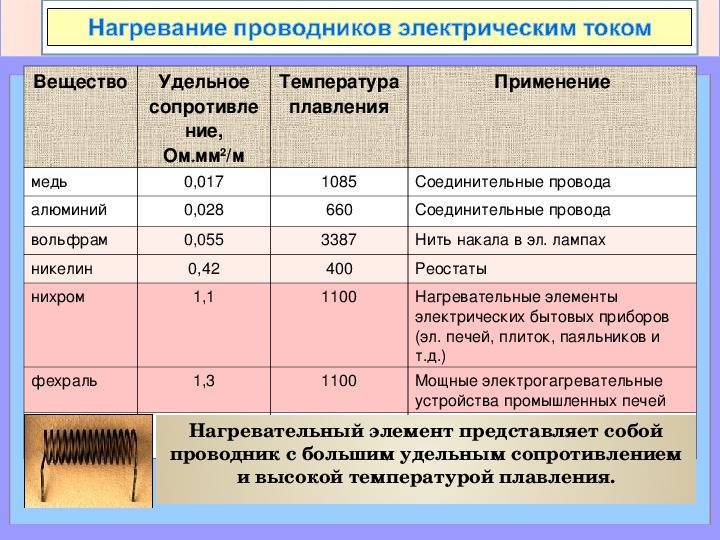
Внутреннее удельное сопротивление металла почти как у стали, поэтому применение тантала логично там, где нужна высокая температура. Его используют в различных нагревательных элементах, например, для высокотемпературных печей.
Кроме того, металл полезен для изготовления линз. Добавление его оксида в стекло повышает их оптические качества. Из тантала с добавлением титана делают жаропрочные сплавы, стойкие к коррозиям. Из его карбида изготавливают инструменты для резки металлов.
Подходит он и для производства фильеров, лабораторной посуды, авиакосмической техники. В последнее время, тантал всё больше завоёвывает славу ювелирного металла и применяется для изготовления украшений.
Трубная продукция
Отдельной отраслью, использующей танталовые трубки, теплообменники выступает атомная энергетика. Обладая высокой жаропрочностью, низким сечением захвата нейтронов, элемент долгое время занимал основную долю в конструкционном материале ядерных установок.
Теплообменник из танталовых труб на одной из АЭС
Сегодня, тантал вытесняется из этой отрасли ниобием. Однако сдавать, списанные из атомно-энергетической сферы, танталовые изделия вряд ли получится в силу комплекса препятствий:
запрет на реализацию;
невозможность достать этот вид вторичного металла;
угроза для здоровья.
Напротив, исключительная инертность тантала относительно кислот находит применение редкому металлу в химической и лабораторной целях. Из танталовых трубок изготавливаются змеевики, магистрали для подачи соляной кислоты, мешалки. Некоторые разновидности лабораторной посуды также исполнены из этого материала. Несмотря на долгие термины службы, окупающие высокую стоимость танталовой продукции, изделия со временем изнашиваются и подлежат замене. Некоторая часть списанной трубной продукции успевает просочиться на пункты приема металлолома.
Изделия из тантала
Остается добавить, что не все трубы изготовлены из марки высокочистого тантала ТВЧ. Существенный процент этих изделий исполнен из сплава этого металла с вольфрамом. Марки этих жаропрочных соединений ТВ-5 (10,15) содержат тантала на уровне 95 – 85%.
Где используется
Первой сферой применения стали лампы бытовой радиоэлектроники.
Сегодня достоинства металла – пластичность, тугоплавкость, устойчивость к агрессивным средам, коррозии, совместимость с биологическим материалом изучены досконально. Они обусловили применение продукции промышленностью, оборонным комплексом, медициной, наукой.

Промышленность, ВПК
Применение металла в гражданском сегменте:
- Металлурги добавляют вещество в сплавы для устойчивости к жару, коррозии. Продукция идет на аппаратуру для химпрома, лабораторий, тигли для выплавки проблемных элементов (особенно редкоземельных металлов).
- Благодаря низкому порогу сверхпроводимости востребован при производстве электронно-вычислительных приборов.
- Карбид вещества – компонент сверхтвердых сплавов. Из сталей, маркированных индексом ТТ, делают оборудование для работы в экстремальных условиях (бурение скважин, композитов, других сверхтвердых материалов).
- Супертвердый неокисляемый бериллид используют строители космических аппаратов (ракет, спутников, самолетов).
- Танталово-ниобиевый сплав – материал конденсаторов для электролиза.
Оболочка снарядов с повышенной бронебойностью состоит из тантала.
Ядерный комплекс
Высшая из металлов устойчивость в жаре, неуязвимость к воздействию паров цезия обусловили применение металла в защитных оболочках объектов ядерной энергетики.
Тантал-180 «застревает» в конструкциях атомных реакторов. И служит источником энергии, гамма-излучения для лазерного оружия, транспорта специального назначения.
Пятиокись (2%) добавляют к стеклу, поглощающему гамма-лучи.
Другие сферы
- Биологически совместимый с организмом человека металл – материал скелетных протезов. Хирурги используют танталовую фольгу, проволоку комплексно: наложение швов, скрепление нервных окончаний.
- Ювелиры оценили способность металла образовывать на поверхности изделия прочные разноцветные пленки.
- Казахстан радует нумизматов: Национальный банк страны чеканит коллекционные танталово-серебряные монеты.
Область применения тантала
В последнее время тантал вызвал большой интерес из-за его использования в конденсаторах в электронном оборудовании. Преимущество его в высокой объемной эффективности, которая обеспечивает миниатюризацию, высокую надежность и стабильность в широком диапазоне температур от -55 С до 125 С.
Тантал используется в различных сплавах для придания высокой прочности, пластичности и температуры плавления. При втягивании в тонкую проволоку она может использоваться в качестве нити для испарения металлов, таких как алюминий. Элемент также используется для изготовления химического технологического оборудования, ядерных реакторов, авиационных и ракетных деталей.
Оксид тантала используется для изготовления специального стекла с высоким показателем преломления для таких предметов, как, например, объективы камер. Та используется для изготовления электролитических проводников, авиационных двигателей, деталей вакуумных печей, ядерных реакторов и деталей ракет. Та не подвержен воздействию жидкостей организма и не вызывает раздражения, что делает его полезным для хирургических приборов.
Распространено его применение в производстве сотовых телефонов, персональных компьютеров, микросхем зажигания в автомобильных подушках безопасности, режущих инструментов, сверл, зубьев для экскаваторов, пуль и теплозащитных экранов. Поскольку металл является электрическим проводником, он полезен во многих электронных приборах, таких как микропроцессоры для плазменных телевизоров.
Танталовый пруток
Виды и области применения
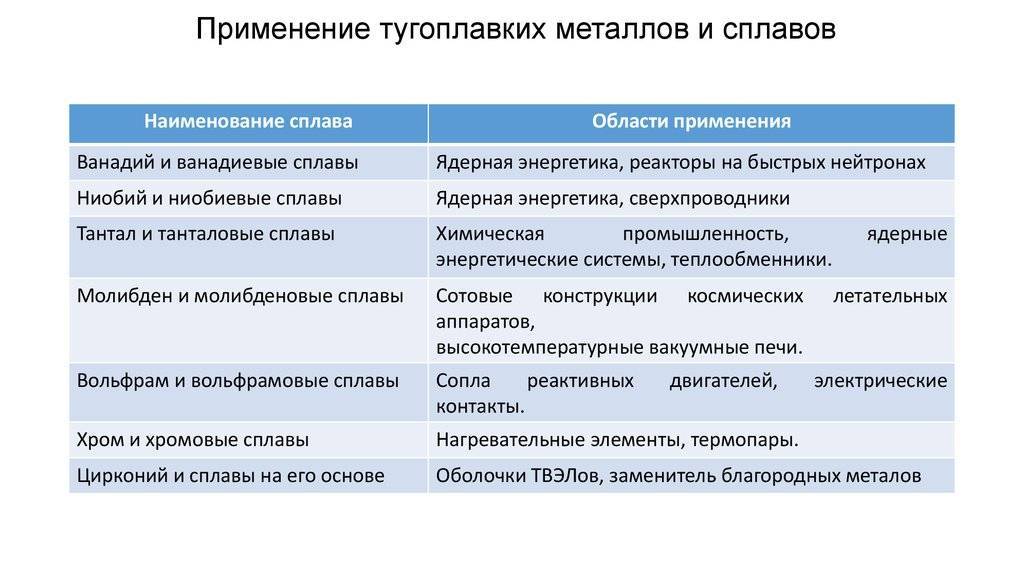
Благодаря своим уникальным качествам тугоплавкие металлы очень полезны для различных областей применения и отраслей. Их основные преимущества:
- Сверхвысокая точка плавления. В частности, к тугоплавким металлам относятся вольфрам, молибден и тантал, которые применяются при производстве стекла;
- Прочность при сверхвысоких температурах. Например, конусы ракет, сделанные из вольфрама, имеют вдвое большую прочность на разрыв, чем железо при нормальных температурах;
- Превосходная стойкость к истиранию и износу, что позволяет продлить срок службы седел клапанов, уплотнений, форсунок и других участков, подверженных сильному износу;
- Отличная коррозионная стойкость, поэтому особо ответственные трубопроводы на химических предприятиях обычно изготавливаются из тугоплавких металлов;
- Устойчивость к тепловому удару. В частности, вольфрамовые изделия могут противостоять нагрузкам, вызванным быстрым расширением из-за резких перепадов температуры;
- Тепловая и электрическая проводимость, вследствие чего из вольфрама и молибдена изготавливают детали радиаторов;
- Чрезвычайная твердость, поэтому высокостойкий режущий штамповый и бурильный инструмент производят из карбида вольфрама;
- Высокая плотность тугоплавких металлов – причина их применения при изготовлении головок клюшек для гольфа и авиационных гироскопов.
Кроме того, эти материалы используются в качестве катализаторов химических реакций, при процессах ядерного синтеза и т.д.
К тугоплавким металлам относятся получившие особое распространение вольфрам, молибден, ниобий, тантал, рений и хром. Об особенностях их применения – далее.
Вольфрам
Вольфрам – самый распространенный среди тугоплавких металлов. Он имеет самую высокую температуру плавления и одну из самых высоких плотностей. Обладает также высокой устойчивостью к коррозии. Широко используется в проволочных волокнах, например, в большинстве ламп накаливания, используемых в домах, а также в промышленных дуговых лампах и прочей технике для освещения.
Молибден
Молибден – наиболее используемый тугоплавкий металл из всех, потому что он дешевле, чем большинство других, и, когда он превращен в сплав, может быть очень устойчивым к ползучести и высоким температурам. Он также не образует амальгам, что делает его устойчивым к коррозии.
Молибден используется для упрочнения стальных сплавов, особенно в конструкционных трубопроводах и насосно-компрессорных трубах. Этот металл также обладает отличными антифрикционными качествами, что делает его идеальным компонентом масел и смазок, используемых в автомобилях.
Ниобий
Обладает оптимальным сочетанием пластичности и прочности. Его можно использовать при изготовлении электролитических конденсаторов, сверхпроводников, ядерных реакторов и электронных ламп.
Тантал
Более других устойчив к коррозии, поэтому находит применение в медицине (особенно – хирургии), а также в средах с повышенной кислотностью. Тантал также является основным компонентом компьютерных, телефонных и конденсаторных цепей.
Рений
Известен своей высокой прочностью на разрыв и пластичностью. Он широко используется в ядерных реакторах, гироскопах и других электрических компонентах. Из-за своей редкости рений очень дорог. Понятие коррозионной стойкости особенно актуально именно для рения, потому что он очень летуч. Может терять устойчивость к воздействию кислорода при высоких температурах, поскольку оксидный слой активно испаряется.
Физические свойства [ править | править код ]
Тантал обладает высокой температурой плавления — 3290 K ( 3017 °C ); кипит при 5731 K ( 5458 °C ) . Плотность тантала — 16,65 г/см³ . Несмотря на твёрдость, пластичен, как золото. Чистый тантал хорошо поддаётся механической обработке, легко штампуется, раскатывается в проволоку и тончайшие листы толщиной в сотые доли миллиметра. Тантал является отличным геттером (газопоглотителем), при 800 °C он способен поглотить 740 объёмов газа. Кристаллическая решётка — кубическая, объёмноцентрированная . Обладает парамагнитными свойствами .
При температуре ниже 4,45 К переходит в сверхпроводящее состояние .
Изотопы
Известны изотопы тантала с массовыми числами от 155 до 190 (количество протонов 73, нейтронов от 82 до 117), и более 30 ядерных изомеров.
Природный тантал состоит из смеси стабильного изотопа и стабильного изомера: 181 Та (99,9877 %) и 180m Та (0,0123 %). Последний является чрезвычайно стабильным изомером (возбуждённым состоянием) изотопа 180 Та, период полураспада которого всего чуть более 8 часов .
История
Тантал был обнаружен в Швеции в 1802 году Андерсом Экебергом в двух образцах минералов – одном из Швеции и другом из Финляндии. Годом ранее Чарльз Хэтчетт открыл колумбий (ныне ниобий), а в 1809 году английский химик Уильям Хайд Волластон сравнил его оксид, колумбит с плотностью 5,918 г / см 3 , с оксидом тантала, танталитом с плотностью 7,935 г. / см 3 . Он пришел к выводу, что эти два оксида, несмотря на разницу в измеренной плотности, были идентичны, и сохранил название тантал. После того, как Фридрих Велер подтвердил эти результаты, было решено, что колумбий и тантал являются одним и тем же элементом. Этот вывод был оспорен в 1846 году немецким химиком Генрихом Роузом , который утверждал, что в образце танталита есть два дополнительных элемента, и назвал их в честь детей Тантала : ниобий (от Ниобы , богини слез) и пелопий ( от Пелопса ). Предполагаемый элемент «пелопий» позже был идентифицирован как смесь тантала и ниобия, и было обнаружено, что ниобий идентичен колумбию, уже обнаруженному в 1801 году Хэтчеттом.
Различия между танталом и ниобием были недвусмысленно продемонстрированы в 1864 году Кристианом Вильгельмом Бломстрандом и Анри Этьеном Сент-Клер Девиль , а также Луи Дж. Тростом , который определил эмпирические формулы некоторых из их соединений в 1865 году. швейцарский химик Жан Шарль Галиссар де Мариньяк в 1866 году доказал, что существует только два элемента. Эти открытия не мешали ученым публиковать статьи о так называемом ильмении до 1871 года. Де Мариньяк был первым, кто произвел металлическую форму тантала в 1864 году, когда он восстановил хлорид тантала, нагревая его в атмосфере водорода . Ранние исследователи были только в состоянии произвести нечистый тантал, и первый относительно чистый пластичный металл был произведен Вернером фон Болтон в Шарлоттенбург в 1903. Провода , сделанный с металлическим танталом были использованы для электрической лампочки нитей , пока вольфрам не заменил его широкое применение.
Название тантал произошло от имени мифологического Тантала , отца Ниобы в греческой мифологии . По сюжету, он был наказан после смерти, будучи приговорен к тому, чтобы стоять по колено в воде с прекрасными фруктами, растущими над его головой, и то и другое вечно мучило его. (Если он наклонился, чтобы выпить воду, она стекала ниже того уровня, которого он мог достичь, а если он потянулся за фруктом, ветви выскользнули из его хватки.) Андерс Экеберг писал: «Этот металл я называю танталом … отчасти в аллюзии. к его неспособности при погружении в кислоту поглощать любые вещества и насыщаться ».
В течение многих десятилетий, коммерческая технология для отделения тантала от ниобия включала фракционную кристаллизацию из гептафторотанталата вдали от калия oxypentafluoroniobate моногидрата, процесс , который был обнаружен Галиссаром де Мариньяка в 1866. Этого метод был вытеснен экстракцией растворителя из фторсодержащих растворы тантала.
ГОСТ металла
Существует несколько методов установления ГОСТа тантала и его окиси, например, фотометрический и спектральный.
Спектральный метод (ГОСТ 18904.8) устанавливает содержание примесей кальция, вольфрама, меди, кобальта, натрия, молибдена в тантале и его окиси. Результатом анализа служит среднее арифметическое, полученное от 2 определений различных навесок.
Фотометрический метод (ГОСТ 18904.1) определяет содержание массовой доли вольфрама и молибдена в тантале и окиси. В этом случае результат анализа подсчитывают как среднее арифметическое 3 определений, которые выполняют из отдельных навесок.
Месторождения и добыча
Доля тантала в земной коре — 0,0002 %, что делает его редким металлом. В природе он очень рассеян и присутствует только в виде двух изотопов: тантал 181 и тантал 180. Последний – радиоактивен и совершает полураспад за 1015 лет.
У металла 20 собственных минералов (воджинит, лопарит, колумбит-танталит), и около 60, в которых он часто содержится. Его постоянным спутником является ниобий, он присутствует во всех породах с танталом. Но они довольно редко оказываются пригодны для промышленного освоения. Наиболее используемый минерал — колумбит-танталит.
Производство тантала не всегда выгодное дело. Самые большие месторождения металла находятся в Бразилии, Австралии, Нигерии, США, Франции, Египте. Они также есть в Мозамбике, Таиланде, Демократической Республике Конго, России.
В некоторых странах Африки добыча металла происходит кустарными способами. За владение землями с месторождениями дорогих ископаемых часто происходят вооруженные конфликты. Так как востребованность тантала только увеличивается, он периодически тоже оказывается в центре этих событий. В частности, «танталовыми войнами» за последние десятилетия прославилась Республика Конго. В 2017 году килограмм металла на мировом рынке оценивается примерно в 320 долларов.

Тантал – применение
Стремительное развитие современных технологий сегодня непременно связанно с использованием эффективных материалов и веществ, которые имеют достаточно практичные и весьма полезные свойства и особенности.
В этом ракурсе стоит обратить внимание на такой уникальный химический элемент, как тантал. И это неудивительно, ведь благодаря своим прочностным характеристикам, сегодня применение тантала становится достаточно актуальным во многих сферах промышленности
Чтобы расширить кругозор обывателя в этой теме, опишем подробно физико-химические особенности тантала и расскажем о том, где сегодня весьма успешно применяется этот металл.
Физические свойства
Тантал обладает высокой температурой плавления — 3290 K (3017 °C); кипит при 5731 K (5458 °C). Плотность тантала — 16,65 г/см³. Несмотря на твёрдость, пластичен, как золото. Чистый тантал хорошо поддаётся механической обработке, легко штампуется, раскатывается в проволоку и тончайшие листы толщиной в сотые доли миллиметра. Тантал является отличным геттером (газопоглотителем), при 800 °C он способен поглотить 740 объёмов газа. Кристаллическая решётка — кубическая, объёмноцентрированная. Обладает парамагнитными свойствами.
При температуре ниже 4,45 К переходит в сверхпроводящее состояние.
Изотопы
Основная статья: Изотопы тантала
Известны изотопы тантала с массовыми числами от 155 до 190 (количество протонов 73, нейтронов от 82 до 117), и более 30 ядерных изомеров.
Природный тантал состоит из смеси стабильного изотопа и стабильного изомера: 181Та (99,9877 %) и 180mТа (0,0123 %). Последний является чрезвычайно стабильным изомером (возбуждённым состоянием) изотопа 180Та, период полураспада которого всего чуть более 8 часов.