Достоинства / недостатки
- Достоинства:
- имеет высокую точку плавления, а следовательно — жаропрочность;
- т.к. плотность данного металла (10200 кг/м3) почти в два раза меньше плотности вольфрама (19300 кг/м3), то сплавы на основе молибдена обладают значительно большей удельной прочностью (при температурах ниже 1370 °С);
- имеет высокий модуль упругости;
- малый температурный коэффициент расширения;
- обладает хорошей термостойкостью;
- малое сечение захвата тепловых нейтронов;
- для молибдена характерна высокая коррозионная стойкость. Данный металл устойчив в большей части щелочных растворов, а также в серной, соляной и плавиковой кислотах при разных температурах и концентрациях.
- Недостатки:
- обладает небольшой окалийностью;
- высокая хрупкость сварных швов;
- малая пластичность при низких температурах;
- упрочнение нагартовкой можно использовать лишь до 700-800 °С, при более высоких температурах происходит разупрочнение из-за возврата.
Характеристика материала
Физические свойства. Молибден – редкоземельный металл серого цвета, внешне похож на свинец. Температура плавления 2619 ºС.
Отличается повышенной пластичностью. Модуль Юнга 336 ГПа, что в 1,5 раза больше, чем у стали. Плотность составляет 10,2 г\см3. Самым жаростойким металлом считается вольфрам. Но касаемо удельной жаропрочности при температурах до 1400 ºС, молибден не имеет конкурентов. Молибден имеет низкое значение коэффициента линейного расширения. При изменении температуры на 1000 ºС, его размер увеличится всего на 0,0049 мм.
Теплопроводность составляет 300 Вт\м К. Электросопротивление 5,6 мкОМ см. После предварительной механической и термической обработок прочность металла может составлять 20-23 кг\мм2. Обладает парамагнитными свойствами.
Среди недостатков отметим низкую пластичность при температурах ниже -30 ºС.
Химические свойства. Молибден полностью устойчив к воздействию окружающей среды в обычных атмосферных условиях. Процесс окисления начинается при 420 ºС, образуя соединение низкой твердости оксид молибдена.
Молибден инертен к водороду при температуре до 2620 ºС. Нейтрален к таким элементам как углерод, фтор, кремний, азот, сера. Молибден не вступает в химические реакции с основными видами кислот: соляная, серная, азотная, фтористая.
Технологические свойства. В условиях комнатной температуры молибденовый круг радиусом 5 мм может быть завязан в узел без использования специального оборудования или быть раскатанным до толщины 0,1 мм. Такая податливость металла способствует получению разных видов профильного проката.
Молибден хорошо обрабатывается методом резания при условии применения смазочно-охлаждающей жидкости на основе серы.
Молибден не выделяется качеством сварных швов. Относится к 3 группе свариваемости. Процесс сварки осуществляется дуговым методом. Для придания сварным соединениям большей пластичности зона контакта должна находиться в среде защитных газов. Предпочтение здесь отдается гелию или аргону.
Биологические свойства. Молибден содержится в организме человека в пределах 8-10 мг. Прежде всего, он влияет на протекание анаболических процессов. Усиливает воздействие витамина С, тем самым способствует усилению иммунной системы. Молибден является регулятором меди, предотвращает ее накапливание в крови.
Молибденовые сплавы имеют характерную особенность химического состава – низкий процент содержания легирующих элементов. Только двухкомпонентные твердые растворы имеют значительный процент вольфрама в своем составе (до 50%).
Основными отечественными марками молибденового сплава являются:
- Молибденовый сплав ЦМ-2А. Легирующими добавками служат титан (0,07-03%) и цирконий (0,07-0,15%). Помимо данных элементов может включать карбидные фазы (до 0,004%). Предел прочности составляет 30 кг\мм2. Значительно падает после прохождения температурного порога в 1200 С. Основные преимущества сплава – технологичность и пластичность, которые дают возможность получения из него производственных полуфабрикатов.
- Молибденовый сплав ВМ-1 значительно не отличается от вышеописанного сплава. Имеет аналогичные показатели как химических, так и механических свойств.
- Молибденовый ВМ-2 имеет в своем составе больший процент циркония, делая его более жаростойким. Это позволяет ему выдерживать температуры в 1300-1400 С окружающей среды. Обладает пределом прочности 48 кг\мм2, в 1,6 раза выше чем у ЦМ-2А.
- Дополнительное легирование молибденового сплава ВМ-3 титаном (1,3%), цирконием (0,6%), ниобием (1,8%) приводит к дальнейшему увеличению жаропрочности. Выдерживает нагрузки до 27 кг\мм2 при температуре до 1360 С. Однако ВМ-3 имеет пониженный уровень пластичности. Это делает его менее технологичным и ограничивает применение в производстве.
Производство и обработка сплавов на основе железа
Чтобы понять, как получают популярные соединения на основе железа, нужно кратко поговорить о технологиях получения чугуна, стали. Получить сталь можно несколькими способами:
- Прямая технология. Окатышки железной руды продуваются смесью угарного газа, кислорода аммиака. Процедура проводиться в шахтной печи разогретой до 1000 градусов.
- Мартеновский метод. Твердый чугун переплавляют с помощью мартеновских печей. Прежде чем закончить процедуру материал насыщается примесями.
- Электроплавильный способ. С его помощью получают высококачественный материал. Обработка проводится в закрытых печах при температуре до 2200 градусов.
- Кислородно-конверторный метод. Чугун, расположенный в печи, обдувается смесью кислорода с воздухом, что ускоряет процесс отжига.
Производство чугуна:
- Подготовка руды. Она дробится до мелкой фракции.
- Измельчение коксового угля.
- Дробление флюса.
- Загрузка в печь.
Для изготовления чугуна используются доменные печи.
Помимо процессов производства смесей, их подвергают дополнительно обработке. Это отжиг, нормализация, закалка и отпуск. Характеристики улучшаются.
Сплавы железа используются в разных отраслях промышленности. Они обладают разными характеристиками, однако не теряют параметров основного металла, входящего в их состав.
Влияние хим. элементов на свойства стали.
Условные обозначения химических элементов:
| хром ( Cr ) — Х никель ( Ni ) — Н молибден ( Mo ) — М титан ( Ti ) — Т медь ( Cu ) — Д ванадий ( V ) — Ф вольфрам ( W ) — В | азот ( N ) — А алюминий ( Аl ) — Ю бериллий ( Be ) — Л бор ( B ) — Р висмут ( Вi ) — Ви галлий ( Ga ) — Гл | иридий ( Ir ) — И кадмий ( Cd ) — Кд кобальт ( Co ) — К кремний ( Si ) — C магний ( Mg ) — Ш марганец ( Mn ) — Г | свинец ( Pb ) — АС ниобий ( Nb) — Б селен ( Se ) — Е углерод ( C ) — У фосфор ( P ) — П цирконий ( Zr ) — Ц |
ВЛИЯНИЕ ПРИМЕСЕЙ НА СТАЛЬ И ЕЕ СВОЙСТВА
Углерод — находится в стали обычно в виде химического соединения Fe3C, называемого цементитом. С увеличением содержания углерода до 1,2% твердость, прочность и упругость стали увеличиваются, но пластичность и сопротивление удару понижаются, а обрабатываемость ухудшается, ухудшается и свариваемость.
Кремний — если он содержится в стали в небольшом количестве, особого влияния на ее свойства не оказывает.(Полезная примесь; вводят в качестве активного раскислителя и остается в стали в кол-ве 0,4%)
Марганец — как и кремний, содержится в обыкновенной углеродистой стали в небольшом количестве и особого влияния на ее свойства также не оказывает. (Полезная примесь; вводят в сталь для раскисления и остается в ней в кол-ве 0,3-0,8%. Марганец уменьшает вредное влияние кислорода и серы.
Сера — является вредной примесью. Она находится в стали главным образом в виде FeS. Это соединение сообщает стали хрупкость при высоких температурах, например при ковке, — свойство, которое называется красноломкостью. Сера увеличивает истираемость стали, понижает сопротивление усталости и уменьшает коррозионную стойкость. В углеродистой стали допускается серы не более 0,06-0,07%. ( От красноломкости сталь предохраняет марганец, который связывает серу в сульфиды MnS).
Фосфор — также является вредной примесью. Снижает вязкость при пониженных температурах, то есть вызывает хладноломкость. Обрабатываемость стали фосфор несколько улучшает, так как способствует отделению стружки.
ЛЕГИРУЮЩИЕ ЭЛЕМЕНТЫ И ИХ ВЛИЯНИЕ НА СВОЙСТВА СТАЛИ
Хром (Х) — наиболее дешевый и распространенный элемент. Он повышает твердость и прочность, незначительно уменьшая пластичность, увеличивает коррозионную стойкость; содержание больших количеств хрома делает сталь нержавеющей и обеспечивает устойчивость магнитных сил.
Никель (Н) — сообщает стали коррозионную стойкость, высокую прочность и пластичность, увеличивает прокаливаемость, оказывает влияние на изменение коэффициента теплового расширения. Никель – дорогой металл, его стараются заменить более дешевым.
Вольфрам (В) — образует в стали очень твердые химические соединения – карбиды, резко увеличивающие твердость и красностойкость. Вольфрам препятствует росту зерен при нагреве, способствует устранению хрупкости при отпуске. Это дорогой и дефицитный металл.
Ванадий (Ф) — повышает твердость и прочность, измельчает зерно. Увеличивает плотность стали, так как является хорошим раскислителем, он дорог и дефицитен.
Кремний (С)- в количестве свыше 1% оказывает особое влияние на свойства стали: содержание 1-1,5% Si увеличивает прочность, при этом вязкость сохраняется. При большем содержании кремния увеличивается электросопротивление и магнитопроницаемость. Кремний увеличивает также упругость, кислостойкость, окалиностойкость.
Марганец (Г) — при содержании свыше 1% увеличивает твердость, износоустойчивость, стойкость против ударных нагрузок, не уменьшая пластичности.
Кобальт (К) — повышает жаропрочность, магнитные свойства, увеличивает сопротивление удару.
Молибден (М) — увеличивает красностойкость, упругость, предел прочности на растяжение, антикоррозионные свойства и сопротивление окислению при высоких температурах.
Титан (Т) — повышает прочность и плотность стали, способствует измельчению зерна, является хорошим раскислителем, улучшает обрабатываемость и сопротивление коррозии.
Ниобий (Б) — улучшает кислостойкость и способствует уменьшению коррозии в сварных конструкциях.
Алюминий (Ю) — повышает жаростойкость и окалиностойкость.
Медь (Д) — увеличивает антикоррозионные свойства, она вводится главным образом в строительную сталь.
Церий — повышает прочность и особенно пластичность.
Цирконий (Ц) — оказывает особое влияние на величину и рост зерна в стали, измельчает зерно и позволяет получать сталь с заранее заданной зернистостью.
Лантан, цезий, неодим — уменьшают пористость, способствуют уменьшению содержания серы в стали, улучшают качество поверхности, измельчают зерно.
Марки и сплавы
Промышленностью используется молибден как чистый металл, с присадками и сплавы.
Номенклатура марок включает десятки позиций. Самых распространенных несколько:
| Марка | Характеристики |
| МЧ | Mo – присадки отсутствуют. |
| МЧВП | Mo – присадки отсутствуют, выплавлен в вакууме. |
| МРН | Mo – присадки отсутствуют, но есть примеси. |
| МК | Mo + присадка (щелочной кремний). |
| ЦМ | Mo + присадка (циркониевая либо титановая). |
| МВ | Сплав «молибден-вольфрам». |
| МР | Сплав «молибден-рений». |
Для повышения твердости металлом снабжают кобальтово-хромовые сплавы.
У сплавов «молибден + никель + кобальт + хром» повышается сопротивляемость кислотам и термовоздействию.
Нахождение в природе
Содержание в земной коре — 3⋅10−4 % по массе. В свободном виде молибден не встречается. В земной коре молибден распространён относительно равномерно. Меньше всего содержат молибдена ультраосновные и карбонатные породы (0,4—0,5 г/т). Концентрация молибдена в породах повышается по мере увеличения SiO2. Молибден находится также в морской и речной воде, в золе растений, в углях и нефти. Содержание молибдена в морской воде колеблется от 8,9 до 12,2 мкг/л для разных океанов и акваторий. Общим является то, что воды вблизи берега и верхние слои меньше обогащены молибденом, чем воды на глубине и вдали от берега. Наиболее высокие концентрации молибдена в породах связаны с акцессорными минералами (магнетит, ильменит, сфен), однако основная масса его заключена в полевых шпатах и меньше в кварце. Молибден в породах находится в следующих формах: молибдатной и сульфидной в виде микроскопических и субмикроскопических выделений, изоморфной и рассеянной (в породообразующих минералах). Молибден обладает большим сродством с серой, чем с кислородом, и в рудных телах образуется сульфид четырёхвалентного молибдена — молибденит. Для кристаллизации молибденита наиболее благоприятны восстановительная среда и повышенная кислотность. В поверхностных условиях образуются преимущественно кислородные соединения MO6+. В первичных рудах молибденит встречается в ассоциации с вольфрамитом и висмутином, с минералами меди (медно-порфировые руды), а также с галенитом, сфалеритом и урановой смолкой (в низкотемпературных гидротермальных месторождениях). Хотя молибденит считается устойчивым сульфидом по отношению к кислым и щелочным растворителям, в природных условиях при длительном воздействии воды и кислорода воздуха молибденит окисляется, и молибден может интенсивно мигрировать с образованием вторичных минералов. Этим можно объяснить повышенные концентрации молибдена в осадочных отложениях — углистых и кремнисто-углистых сланцах и углях.
Известно около 20 минералов молибдена. Важнейшие из них: молибденит MoS2 (60 % Mo), повеллит CaMoO4 (48 % Mo), молибдит Fe(MoO4)3·nH2O (60 % Mo) и вульфенит PbMoO4.
Месторождения
Крупные месторождения молибдена известны в США, Мексике, Чили, Канаде, Австралии, Норвегии, России. В России молибден выпускают на Сорском ферромолибденовом заводе. Более 7 % от мировых запасов молибдена расположены в Армении, причем 90 % из них сосредоточены в Каджаранском медно-молибденовом месторождении.
В космосе
Аномально высокое содержание молибдена наблюдается в звёздных образованиях, состоящих из красного гиганта (или сверхгиганта), внутри которого находится нейтронная звезда — объектах Ландау — Торна — Житковой.
Применение
Молибден используется для легирования сталей, как компонент жаропрочных и коррозионностойких сплавов. Молибденовая проволока (лента) служит для изготовления высокотемпературных печей, вводов электрического тока в лампочках. Соединения молибдена — сульфид, оксиды, молибдаты — являются катализаторами химических реакций, пигментами красителей, компонентами глазурей. Гексафторид молибдена применяется при нанесении металлического Mo на различные материалы, MoS2 используется как твердая высокотемпературная смазка. Mo входит в состав микроудобрений. Радиоактивные изотопы 93Mo (T1/2 6,95ч) и 99Mo (T1/2 66ч) — изотопные индикаторы.
Молибден — один из немногих легирующих элементов, способных одновременно повысить прочностные и вязкие свойства стали. Обычно при легировании одновременно с увеличением прочности растет и хрупкость металла. Известны случаи использования молибдена при изготовлении в Японии холодного оружия в XI — XIII вв.
В 2005 мировые поставки молибдена (в пересчёте на чистый молибден) составили, по данным «Sojitz Alloy Division», 172,2 тыс. тонн (в 2003 — 144,2 тыс. тонн). Чистый монокристаллический молибден используется для производства зеркал для мощных газодинамических лазеров. Теллурид молибдена является очень хорошим термоэлектрическим материалом для производства термоэлектрогенераторов (термо-э.д.с 780 мкВ/К). Трёхокись молибдена (молибденовый ангидрид) широко применяется в качестве положительного электрода в литиевых источниках тока.
Свойства молибдена (таблица): температура, плотность, давление и пр.:
Подробные сведения на сайте ChemicalStudy.ru
| 100 | Общие сведения | |
| 101 | Название | Молибден |
| 102 | Прежнее название | |
| 103 | Латинское название | Molybdaenum |
| 104 | Английское название | Molybdenum |
| 105 | Символ | Mo |
| 106 | Атомный номер (номер в таблице) | 42 |
| 107 | Тип | Металл |
| 108 | Группа | Переходный, тяжёлый металл |
| 109 | Открыт | Карл Вильгельм Шееле, Швеция, 1778 г. |
| 110 | Год открытия | 1778 г. |
| 111 | Внешний вид и пр. | Блестящий металл серебристо-белого цвета |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 0,00011 % |
| 120 | Содержание в морях и океанах (по массе) | 1,0·10-6 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 5,0·10-7 % |
| 122 | Содержание в Солнце (по массе) | 9,0·10-7 % |
| 123 | Содержание в метеоритах (по массе) | 0,00012 % |
| 124 | Содержание в организме человека (по массе) | 0,00001 % |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 95,96(2) а. е. м. (г/моль) |
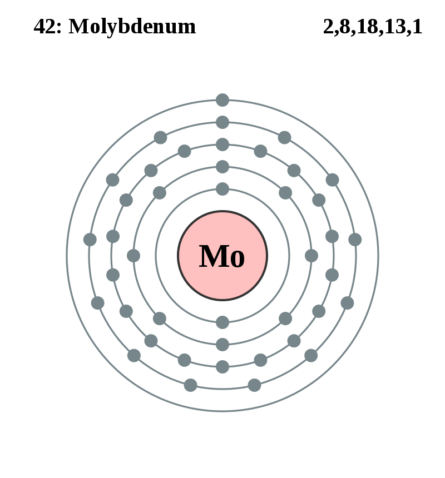
| 202 | Электронная конфигурация | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d5 5s1 |
| 203 | Электронная оболочка | K2 L8 M18 N13 O1 P0 Q0 R0
|
| 204 | Радиус атома (вычисленный) | 190 пм |
| 205 | Эмпирический радиус атома* | 154 пм |
| 206 | Ковалентный радиус* | 154 пм |
| 207 | Радиус иона (кристаллический) | Mo3+ 83 (6) пм, Mo4+ 79 (6) пм Mo5+ 75 (6) пм, Mo6+ 73 (6) пм (в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | |
| 209 | Электроны, Протоны, Нейтроны | 42 электрона, 42 протона, 54 нейтрона |
| 210 | Семейство (блок) | элемент d-семейства |
| 211 | Период в периодической таблице | 5 |
| 212 | Группа в периодической таблице | 6-ая группа (по старой классификации – побочная подгруппа 6-ой группы) |
| 213 | Эмиссионный спектр излучения | |
| 300 | Химические свойства | |
| 301 | Степени окисления | -4, -2, -1, 0, +1,+2, +3, +4, +5, +6 |
| 302 | Валентность | II, III, IV, V, VI |
| 303 | Электроотрицательность | 2,16 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 684,32 кДж/моль (7,09243(4) эВ) |
| 305 | Электродный потенциал | Mo3+ + 3e– → Mo, Eo = -0,2 В |
| 306 | Энергия сродства атома к электрону | 71,9 кДж/моль |
| 400 | Физические свойства | |
| 401 | Плотность* | 10,28 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело), 9,33 г/см3 (при температуре плавления 2623 °C и иных стандартных условиях, состояние вещества – жидкость) |
| 402 | Температура плавления* | 2623 °C (2896 K, 4753 °F) |
| 403 | Температура кипения* | 4639 °C (4912 K, 8382 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 37,48 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 598 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | 0,251 Дж/г·K (при 25 °C), 0,272 Дж/г·K (при 0-100 °C) |
| 410 | Молярная теплоёмкость* | 24,06 Дж/(K·моль) |
| 411 | Молярный объём | 9,4 см³/моль |
| 412 | Теплопроводность | 138 Вт/(м·К) (при стандартных условиях), 138 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | |
| 512 | Структура решётки | Кубическая объёмно-центрированная
|
| 513 | Параметры решётки | 3,147 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | 450 K |
| 516 | Название пространственной группы симметрии | Im_ 3m |
| 517 | Номер пространственной группы симметрии | 229 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7439-98-7 |
Примечание:
205* Эмпирический радиус атома молибдена согласно и составляет 139 пм.
206* Ковалентный радиус молибдена согласно и составляет 154±5 пм и 130 пм соответственно.
401* Плотность молибдена согласно и составляет 10,22 г/см3 (при 0 °C/20 °C и иных стандартных условиях, состояние вещества – твердое тело).
402* Температура плавления молибдена согласно составляет 2620 °С (2893,15 K, 4748 °F).
403* Температура кипения молибдена согласно и составляет 4611,85 °С (4885 K, 8333,33 °F) и 4630 °С (4903,15 K, 8366 °F) соответственно.
407* Удельная теплота плавления (энтальпия плавления ΔHпл) молибдена согласно и составляет 28 кДж/моль и 36,4 кДж/моль соответственно.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) молибдена согласно составляет 582,4 кДж/моль.
410* Молярная теплоёмкость молибдена согласно составляет 23,93 Дж/(K·моль).
Жаропрочные сплавы
Техника сверхскоростных и космических полетов ставит перед металлургами задачу получать все более жаростойкие материалы. Прочность при высоких температурах зависит прежде всего от типа кристаллической решетки и, конечно, от химической природы материала. Температурный предел эксплуатации титановых сплавов 550— 600° С, молибденовых — 860, а титано-молибденовых — 1500° С!
Чем объяснить столь значительный скачок? Его причина — в строении кристаллической решетки. В объемно-центрированную структуру молибдена внедряются посторонние атомы, на этот раз атомы титана. Получается так называемый твердый раствор внедрения, структуру которого можно представить так. Атомы молибдена, металла-основы, располагаются по углам куба, а атомы добавленного металла, титана,—в центрах этих кубов. Вместо объем-по-центрированной кристаллической решетки появляется гранецентрированная, в которой процессы разупрочнения под действием температур происходят намного менее ий-
В таком целенаправленном изменении кристаллической структуры металлов состоит один из основных принципов легирования.
Другая причина столь резкого увеличения жаропрочности кроется в том, что сплавляются очень непохожие металлы — молибден и титан. Это общее правило: чем больше разница между атомами легирующего металла и металла-основы, тем прочнее образующиеся связи. Металлическая связь как бы дополняется химической.
Легирование, однако, вовсе не последнее слово в решении проблемы жаропрочных сплавов. Уже в наше время обнаружены необычайные свойства нитевидных кристаллов, или «усов». Прочность их по сравнению с металлами, обычно используемыми в технике, поразительно велика. Объясняется это тем, что кристаллическая структура усов практически лишена дефектов, и техника сверхскоростных полетов берет на вооружение усы, создавая с их помощью композиционные жаропрочные материалы. Один из таких материалов — это окись алюминия, армированная молибденовыми усами, другой представляет собой начиненный топ же арматурой технический титан. По сравнению с обычным титаном этот материал может работать в жестких условиях в 1000 раз дольше.
Что можно противопоставить огненному смерчу, обрушивающемуся на космический корабль при входе в плотные слои атмосферы? Прежде всего теплозащитную обмазку и охлаждение. Да, охлаждение, подобное в принципе охлаждению автомобильных двигателей с помощью радиаторов. Только работать здесь должны более энергоемкие процессы. Много тепла нужно на испарение веществ, но еще больше на сублимацию — перевод из твердого состояния непосредственно в газообразное. При высоких температурах сублимировать способны молибден, вольфрам, золото. Покрытие носовой части корабля молибденом или другим из перечисленных (более дорогих) металлов в значительной мере ослабит силу огненного смерча, через который надо пройти возвращаемому аппарату космического корабля.
Другие отрасли
Львиную долю продукции из молибдена, сплавов металла забирают производители радио- и электрических ламп, радиоэлектроники.
Материала хватает и на другие цели:
- Пресс-формы, детали машин для литья сплавов под давлением.
- Электровакуумное производство (рентгеновские трубки).
- Положительный электрод источников тока на основе лития.
- Оболочки деталей ядерных реакторов.
- Нагреватели электропечей, функционирующих в жестких условиях.
- Внешний слой «носового» сегмента корпуса сверхзвуковых самолетов.
- Электроды для выплавки стекла.
- Катализ химических реакций.
- Лаки, краски для фарфора, текстиля, мехов.
Эта продукция создается на основе природных соединений и сплавов металла.
Ассортимент: узлы ракетных (ионных, плазменных) двигателей; обшивка спускаемых аппаратов; теплообменники. Здесь свойства молибдена корректируют сплавы с ниобием и танталом.
Чистый кристаллический Mo используется как компонент зеркал для лазеров специального назначения.
Химический состав
Каждая вышеуказанная характеристика 8Cr13MoV обусловлена особенностями химического состава, включающего в себя такие элементы:
углерод – 0,8%
Вместе с железом является важной частью всех качественных сплавов. Главная его роль – увеличение прочности
Соединения, которые образуются при его помощи, значительно прочнее любого железа. При его содействии металл получает такое важное качество, как возможность упрочняться под воздействием высоких температур. Обратной стороной этой медали является некоторая потеря гибкости и увеличение хрупкости;
марганец – 0,4% и кремний – 0,5%. Обязательные элементы, применяемые почти во всех сталях. Благодаря им сплав очищается от газов, что делает состав однородным, без дефектов. Это улучшает прочность, твёрдость и упругость. Кремний, кроме всех этих свойств, уменьшает возможность возникновения окалин и сколов при закалке;
молибден – 0,2% и ванадий – 0,1%. Благодаря этим элементам металл становится более тугоплавким, но одновременно с этим улучшаются его показатели прочности, уменьшается истирание и возрастает устойчивость к возникновению ржавчины;
хром – 13%. Он улучшает закаливаемость стали и содержится в любой нержавеющей марке, увеличивает износостойкость.
Производство молибдена
Для производства молибдена в России и мире в качестве сырья используются молибденитовые концентраты, из которых получается чистый металл — основа для сплавов. В концентратах содержится около 20 % примесей, 1-9% оксида кремния, 28-32% серы и примерно 50 % молибдена.
Этапы производства:
- Концентрат подвергают окислительному обжигу при температуре 600 ⁰С. На выходе получают оксид молибдена, который содержит значительное количество примесей.
- Оксид очищают от примесей путем выгонки или выщелачивания огарка и дальнейшей нейтрализации.
- В трубчатой печи из чистого оксида получают порошковый металлический молибден. Для этого процесса применяют ток сухого водорода.
- Порошок превращают в металл. Как правило, для этого используют один из двух методов — плавка или порошковая металлургия.
Для получения ферромолибдена применяется реакция восстановления молибденитового концентрата, который предварительно подвергается обжигу.
Польза молибдена для организма
1. Молибден лечит и предотвращает сульфитную чувствительность
Сульфиты являются серосодержащими молекулами. Они используются в пищевой промышленности в качестве средств против потемнения, антиоксидантов и консервантов. Сульфитная чувствительность вызывается продуктами или напитками с высоким содержанием сульфитов, в том числе:
— Безалкогольные напитки и соки в бутылках, пиво и вино
— Курага
— Мясные деликатесы, мясной фарш и колбасы
— Вишня мараскино
— Кислая капуста
— Кленовый сироп
Симптомы чувствительности к сере проявляются в виде:
— хрипоты
— тошноты
— спазмов в желудке
— диареи
— крапивницы
— ощущения покалывания
— шока
— потери сознания
Иногда реакции на сульфит могут быть фатальными. Это подтверждено некоторыми случаями.
Дефицит молибдена может уменьшить количество сульфитоксидазы, которая превращает сульфит в сульфат. Накопление сульфита способно привести к чувствительности к сульфиту.
Сульфиты — это одни из потенциальных аллергенов наряду с арахисом, рыбой, ракообразными, глютеном и молочными продуктами. Об их содержании в продуктах и напитках необходимо указывать на упаковке.
Один пациент с непереносимостью имел повышенный уровень аминокислот, но главным образом l-метионина в крови. При лечении молибденом распад серы у пациента нормализовался.
2. Молибден нормализует уровень мочевой кислоты
В случаях дефицита молибдена в организме нарушается функция ксантиноксидазы, что приводит к низким уровням мочевой кислоты в крови и моче.
Низкие уровни мочевой кислоты из-за дисфункции ксантиноксидазы могут привести к таким расстройствам, как:
- Рассеянный склероз
- Болезнь Альцгеймера
- Болезнь Хантингтона
- Болезнь Паркинсона
Мочевая кислота также действует как сильный антиоксидант и удаляет активные формы кислорода.
3. Молибден улучшает кровообращение
Молибден для организма действует как критический компонент нитратредуктазы. Это фермент, расщепляющий нитрат, который имеет решающее значение для производства оксида азота. Нитрат расщепляется до диоксида азота, прямого предшественника оксида азота.
Оксид азота имеет много преимуществ, в том числе:
- расширяет кровеносные сосуды
- регулирует рост клеток
- защищает кровеносные сосуды от травм
Молибден в организме поддерживает нормальный уровень оксида азота и способствует циркуляции крови.
4. Молибден уменьшает риск рака пищевода и прямой кишки
Население, проживающее на почвах с дефицитом молибдена, имеет более высокий уровень рака пищевода. Кроме того, низкий уровень молибдена является фактором риска развития рака пищевода и прямой кишки у женщин.
5. Молибден необходим для детоксикации алкоголя и других наркотиков
Молибден в организме необходим для правильного функционирования альдегидоксидазы и альдегиддегидрогеназы. Альдегиддегидрогеназа превращает ацетальдегид (вредный продукт алкоголя) в уксусную кислоту.
Альдегидоксидаза также участвует в метаболизме многих фармацевтических препаратов.
6. Молибден способен предотвратить разрушение зубов
Потребление молибдена связывают с более низким уровнем кариеса.
Проведены исследования на эмали зубов у коров. Произведена обработка зубов фторидом с добавлением молибдена. В ходе чего наблюдалась повышенная заживляемость ротовой полости из-за увеличения скорости восстановления минералов.
Где применяется молибден?
В истории самое первое применение молибдена было зафиксировано в Японии еще в 10-13 ст. Существует вероятность, что в те далекие времена, данный металл служил материалом для изготовления холодного оружия.
Сегодня молибденовая промышленность является достаточно развитой отраслью. И, кроме того, что в настоящее время продолжают производить чистый молибден и его сплавы, также существует множество его марок, каждая из которых предназначена для определенных целей. Самые известные марки молибдена:
- МЧ — чистый молибден без присадок. Из этой марки производятся держатели вольфрамовых спиралей и нити накаливания, аноды генераторных ламп.
- МЧВП — чистый молибден без присадок, произведенный методом вакуумной плавки.
- МРН — молибден разного назначения, не содержит присадок, включает большее количество примесей по сравнению с марками МЧ и МЧВП. Предназначена для использования в производстве высокотемпературных нагревателей, экранов, электрических вводов в вакуумные приборы и установки.
- МК — содержит кремнещелочную присадку.
- ЦМ — в качестве присадки используются цирконий и/или титан.
- МР — сплав молибдена с рением.
- МВ — сплав молибдена с вольфрамом.
Таким образом, спустя целые столетия, молибден стал незаменимым компонентом во многих промышленных отраслях. Он применяется:
- в качестве легирующего элемента стали;
- при производстве жаропрочных сплавов, без которых не обходится авиационная, ракетная и ядерная техника;
- для изготовления сплавов, обладающих антикоррозионными свойствами;
- во время производства деталей электровакуумных приборов, нитей ламп накаливания;
- для изготовления лопаток турбин;
- в энергетических ядерных реакторах;
- в качестве смазочных материалов, а также катализатора гидрогенизации;
- при изготовлении лакокрасочных материалов;
- в химической, нефтяной промышленности, а также в металлургии.
Дефицит молибдена
Хотя добавки распространены, дефицит молибдена у здоровых людей встречается очень редко. Несколько исключений, связанных с неблагоприятным состоянием здоровья дефицит молибдена дело было.
В одном случае госпитализированный пациент получал искусственное питание через зонд и не имел молибден не было дано. Это привело к серьезным симптомам, которые привели к частоте сердечных сокращений и дыханию, рвоте, дезориентации и, в конечном итоге, коме.
Долгосрочные в некоторых группах населения дефицит молибдена было замечено и было связано с повышенным риском рака пищевода.
В небольшом регионе Китая рак пищевода встречается в 100 раз чаще, чем в США. Земли в этой области молибден Уровень оказался очень низким, и в результате длительное потребление минералов оказалось низким.
Кроме того, в других регионах с высоким риском рака пищевода, таких как Северный Иран и некоторые части Южной Африки. молибден уровни низкие.
Важно отметить, что это вызвано случаями в отдельных популяциях, и дефицит не является проблемой для большинства людей. Дефицит кофактора молибдена вызывает тяжелые симптомы в младенчестве
Дефицит кофактора молибдена вызывает тяжелые симптомы в младенчестве.
Дефицит кофактора молибдена, младенцы кофактор молибдена Это очень редкое генетическое заболевание, которое он рождается без каких-либо способностей. Следовательно, они не могут активировать четыре важных фермента, упомянутых выше.
Это вызвано рецессивной наследственной мутацией гена, поэтому ребенок должен унаследовать пораженный ген от обоих родителей, чтобы развить его.
Младенцы с этим заболеванием кажутся нормальными при рождении, но заболевают в течение недели и имеют судороги, которые не проходят при лечении.
В их крови накапливается токсичный уровень сульфида, поскольку он не может быть преобразован в сульфат. Это приводит к аномалиям мозга и серьезным задержкам в развитии.
К сожалению, пораженные дети не выживают в раннем детстве. К счастью, такая ситуация встречается крайне редко. До 2010 года в мире было всего 100 зарегистрированных случаев.